
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение кинетической теории газов для давления
|
|
|
|
Простейшая молекулярно-кинетическая модель газа выглядит следующим образом. Газ – это совокупность одинаковых, хаотически движущихся, не взаимодействующих друг с другом на расстоянии молекул. Размеры молекул столь малы, что суммарным объемом их можно пренебречь по сравнению с объемом сосуда. Подавляющую часть времени каждая молекула движется свободно, претерпевая иногда упругие соударения с другими молекулами или со стенками сосуда. Такая модель представляет собой не что иное, как идеальный газ. У реальных газов молекулы обладают конечными размерами и взаимодействуют друг с другом с силами, зависящими от расстояния между молекулами. Только при малых плотностях газа собственный объем молекул мал по сравнению с объемом, занимаемым газом, а средние расстояния между молекулами так велики, что силами взаимодействия молекул друг с другом можно пренебречь.
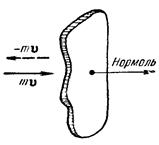
При ударе о стенку сосуда молекула сообщает ей импульс, численно равный изменению импульса молекулы. Каждый элемент поверхности стенки DS непрерывно подвергается бомбардировке большим количеством молекул, в результате чего за время Dt получает суммарный импульс DК, направленный по нормали к DS. Отношение DК/Dt дает, как известно из механики, силу, действующую на DS, а отношение этой силы к DS даст давление р.
Молекулы движутся совершенно беспорядочно, хаотически; все направления движения равновероятны. Основанием для такого утверждения служит то обстоятельство, что давление газа на стенки сосуда всюду одинаково. Если бы движение молекул в каком-то направлении преобладало, давление газа на участок стенки, лежащий в этом направлении, было бы, естественно, больше.
Скорости молекул могут быть самыми различными по величине. Более того, скорость молекулы должна меняться, вообще говоря, при каждом соударении, причем с равной вероятностью она может, как возрасти, так и уменьшиться. Это следует из того, что суммарная кинетическая энергия двух молекул до и после их соударения должна быть одинакова. Следовательно, возрастание скорости одной молекулы должно сопровождаться одновременным уменьшением скорости другой.
|
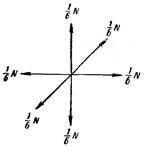
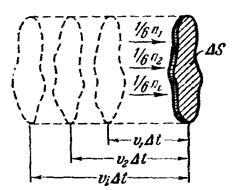
Для облегчения решения поставленной задачи вводят некоторые упрощения, касающиеся характера движения молекул. Во-первых, предполагается, что молекулы движутся только вдоль трех взаимно перпендикулярных направлений. Если газ содержит N молекул, то в любой момент времени вдоль каждого из направлений будет двигаться N/3 молекул, причем половина из них (т. е. N/6) движется вдоль данного направления в одну сторону, половина в противоположную (рисунок). Отсюда следует, что в нужном направлении (например, по нормали к данному элементу стенки DS) движется 1/6 часть молекул. Второе упрощение: все молекулы движутся со скоростью V. Первое упрощение не влияет на конечный результат вычисления давления; уточнения, к которым приводит отказ от второго упрощения, будут выяснены ниже.
|
Вычисление импульса, сообщаемого стенке сосуда ударяющейся о нее молекулой достаточно просто. До удара о стенку импульс молекулы направлен по внешней нормали к DS (рис.) и равен mV. В результате удара импульс меняет знак. Таким образом, приращение импульса молекулы оказывается равным
(- m v)-(m v)= -2 m v. (99.1)
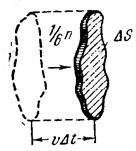
По третьему закону Ньютона стенка получает при ударе импульс 2m v, имеющий направление нормали. За время Dt до элемента стенки DS долетят все движущиеся по направлению к нему молекулы, заключенные в объеме цилиндра с основанием DS и высотой vDt (рис.). Число этих молекул равно
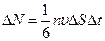 (99.2)
(99.2)
где n – число молекул в единице объема. При вычислении количества молекул, долетающих до стенки, соударения молекул друг с другом можно не принимать во внимание. Это объясняется хаотичным характером движения молекул: число молекул, изменивших направление движения из-за соударений, компенсируется числом молекул, двигавшихся в других направлениях, но также участвовавших в соударениях. В соответствии с (99.2) число ударов молекул о площадку DS за единицу времени будет
|
равно
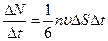 ,
,
а число ударов о единичную площадку DS = 1 м2 за секунду
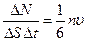 . (99.3)
. (99.3)
Суммарный импульс DК, сообщаемый элементу стенки DS за время Dt получается умножением числа ударов (99.2) на импульс (99.1), сообщаемый стенке при каждом ударе:
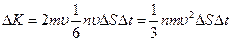
Отношение DК ко времени Dt есть сила, действующая на DS. Отношение полученной силы к площадке DS есть давление газа, оказываемое им на стенки сосуда. Следовательно,
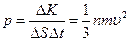
Учитывая, что e = mu 2/2 представляет собой кинетическую энергию поступательного движения молекулы, выражению для давления можно придать следующий вид:
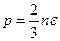 (99.5)
(99.5)
О предположении равенства скоростей всех молекул. Пусть скорости молекул различны, причем из n молекул, содержащихся в единице объема, n 1 молекул имеют скорости, равные u 1, n 2 молекул имеют скорость u 2 и вообще n i молекул имеют скорость u I, то есть существует распределение молекул по скоростям. Очевидно, что
n 1+ n 2 +…+ n i +…= S n i = n
Зная распределение молекул, можно найти среднее значение скорости молекул. Для этого нужно сложить скорости всех n молекул и разделить полученный результат на n:
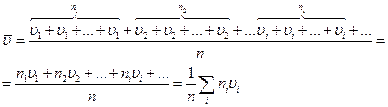 (99.6)
(99.6)
Аналогичные рассуждения для кинетической энергии поступательного движения молекулы e, дают для среднего значения этой энергии следующее выражение:
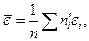 (99.7)
(99.7)
где n ’i – число молекул, обладающих энергией, равной e i. Согласно (99.7) суммарная кинетическая энергия молекул, содержащихся в единице объема, равна 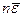 – произведению числа молекул в единице объема на среднюю энергию одной молекулы, причем этот результат не зависит от конкретного вида распределения молекул по скоростям. Если молекулы каким-то образом распределены по скоростям, можно определить число ударов молекул о стенку сосуда.
– произведению числа молекул в единице объема на среднюю энергию одной молекулы, причем этот результат не зависит от конкретного вида распределения молекул по скоростям. Если молекулы каким-то образом распределены по скоростям, можно определить число ударов молекул о стенку сосуда.
Среди молекул, обладающих значением скорости u i, имеются молекулы, движущиеся в самых различных направлениях. Поэтому можно упрощенно считать, что по направлению к элементу стенки DS движется 1/6 часть таких молекул. Следовательно, из числа молекул, имеющих скорость u i, достигает элемента DS (рис. 222) за время Dt
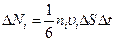 (99.8)
(99.8)
А полное число ударов молекул любых скоростей 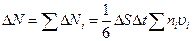 При замене S n i u i в соответствии с (99.6) через
При замене S n i u i в соответствии с (99.6) через 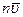 число ударов об единичную площадку в единицу времени оказывается равным:
число ударов об единичную площадку в единицу времени оказывается равным:
|
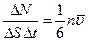 . (99.9)
. (99.9)
Это выражение отличается от полученного нами ранее (99.3) только тем, что вместо одинаковой для всех молекул скорости v в него входит средняя скорость молекул 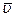 .
.
Замечание. Эта формула также является приближенной. Более строгий расчет приводит к формуле
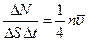 .
.
Каждая из DNi молекул (99.8) при ударе о стенку сообщает ей импульс 2 m ui. Суммарный импульс, сообщаемый DS за время Dt молекулами всех скоростей, равен
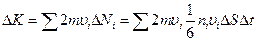
Отсюда давление равно:
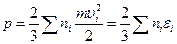 ,
,
где 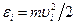 – кинетическая энергия поступательного движения молекулы, имеющей скорость
– кинетическая энергия поступательного движения молекулы, имеющей скорость 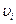 . Замена в соответствии с (99.7) S n i e i на
. Замена в соответствии с (99.7) S n i e i на 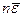 дает:
дает:
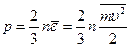 (99.10)
(99.10)
Это выражение отличается от ранее полученного выражения (99.5) тем, что вместо одинаковой для всех молекул энергии e в него входит средняя энергия 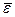 . Уравнение (99.10) является основным в кинетической теории газов.
. Уравнение (99.10) является основным в кинетической теории газов.
Из (99.10) следует, что при постоянном n (т. е. при неизменном объеме данной массы газа) давление пропорционально средней кинетической энергии поступательного движения молекулы 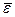 . Вместе с тем температура Т, измеренная по идеальной газовой шкале, определяется как величина, пропорциональная давлению идеального газа при постоянном объеме. Отсюда следует вывод, что температура Т пропорциональна
. Вместе с тем температура Т, измеренная по идеальной газовой шкале, определяется как величина, пропорциональная давлению идеального газа при постоянном объеме. Отсюда следует вывод, что температура Т пропорциональна 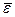 . Чтобы найти коэффициент пропорциональности между абсолютной температурой Т и
. Чтобы найти коэффициент пропорциональности между абсолютной температурой Т и 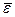 , сопоставим уравнение (99.10) с уравнением состояния идеального газа (98.13). Для этого умножим уравнение (99.10) на объем киломоля Vкм:
, сопоставим уравнение (99.10) с уравнением состояния идеального газа (98.13). Для этого умножим уравнение (99.10) на объем киломоля Vкм:
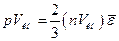 .
.
Замечая, что произведение числа молекул в единице объема на объем одного киломоля равно числу Авогадро, последнее равенство можно написать в виде:
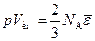
Сопоставление этого уравнения с уравнением состояния идеального газа для одного киломоля pV км = RT показывает, что
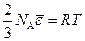
откуда
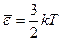 (99.11)
(99.11)
Таким образом: абсолютная температура есть величина, пропорциональная средней энергии движения одной молекулы. Этот вывод справедлив не только для газов, но и для вещества в любом состоянии. Выражение (99.11) замечательно в том отношении, что средняя энергия 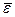 зависит только от температуры и не зависит от массы молекулы. Заменив в уравнении состояния идеального газа R через N A k и учитывая, что NA/Vкм равно n, можно получить важную формулу:
зависит только от температуры и не зависит от массы молекулы. Заменив в уравнении состояния идеального газа R через N A k и учитывая, что NA/Vкм равно n, можно получить важную формулу:
p = nkT. (99.12)
Если имеется смесь нескольких газов, разные по массе молекулы будут иметь различную среднюю скорость, но средняя энергия молекул будет одна и та же. Давление в этом случае будет равно
p = nkT = (nl+n2+...)kT, (99.13)
где nl, n2 и т. д. обозначают количество молекул первого, второго и т. д. сорта, содержащееся в единице объема. Выражение (99.13) может быть представлено в виде
p = n 1 kT + n 1 kT. +… Но n 1 kT – это то давление p1 которое было бы в сосуде, если в нем находились бы только молекулы первого сорта, n 2 kT – то давление р2, которое было бы при наличии в сосуде только молекул второго сорта, и т. д. Давление, обусловленное молекулами какого–либо одного сорта, при условии, что они одни присутствуют в сосуде в том количестве, в каком они содержатся в смеси, называется парциальным давлением соответствующей компоненты газовой смеси. Введя парциальные давления, на основании (99.13) можно написать, что
р = р1+р2+…= Sрi. (99.14)
Таким образом, получен закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1112; Нарушение авторских прав?; Мы поможем в написании вашей работы!