
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия и теплоемкость идеального газа
|
|
|
|
Вследствие того, что молекулы идеального газа на расстоянии не взаимодействуют, внутренняя энергия такого газа будет складываться из энергий отдельных молекул. Следовательно, внутренняя энергия одного киломоля идеального газа будет равна произведению числа Авогадро на среднюю энергию одной молекулы:
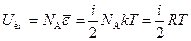 (102.1)
(102.1)
Внутренняя энергия произвольной массы газа m будет равна внутренней энергии одного кмоля, умноженной на число киломолей газа, содержащихся в массе m:

Теплоемкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус. Если сообщение телу количества тепла d'Q повышает его температуру на dT, то теплоемкость по определению равна
 (102.3)
(102.3)
Величина (102.3) имеет размерность дж/град. Теплоемкость киломоля вещества мы будем обозначать буквой С. Размерность С равна дж/град×кмоль. Теплоемкость единицы массы вещества называется удельной теплоемкостью. Ее мы будем обозначать буквой с. Размерность с равна дж/град×кг. Между теплоемкостью киломоля вещества и удельной теплоемкостью того же вещества имеется очевидное соотношение:
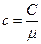 (102.4)
(102.4)
Величина теплоемкости зависит от условий, при которых происходит нагревание тела. Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме (обозначается CV), во втором – теплоемкостью при постоянном давлении (СP). Если нагревание происходит при постоянном объеме, тело не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела:
d ' Q V = dU. (102.5)
Отсюда следует, что теплоемкость любого тела при постоянном объеме равна
 (102.6)
(102.6)
Пользуясь полученным выше выражением для внутренней энергии киломоля вещества при постоянном объеме, получим:
 (102.7)
(102.7)
То есть теплоемкость идеального газа при постоянном объеме оказывается постоянной величиной, не зависящей от параметров состояния газа, в частности от температуры. С учетом (102.7) выражение для внутренней энергии идеального газа может быть записано в следующем виде:
Uкм = CVT (102.8)
Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая над внешними телами положительную работу. Следовательно, для повышения температуры газа на один градус в этом случае понадобится больше тепла, чем при нагревании при постоянном объеме, – часть тепла будет затрачиваться на совершение газом работы. Поэтому теплоемкость при постоянном давлении также должна быть больше, чем теплоемкость при постоянном объеме.
Первое начало термодинамики для киломоля газа имеет вид:
d' Q P = d U км + p d V км, (102.9)
Индекс р при d'Q указывает на постоянство давления. Деление (102.9) на dT дает выражение для теплоемкости киломоля газа при постоянном давлении:
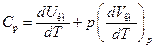 (102.10)
(102.10)
Слагаемое 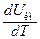 есть теплоемкость киломоля при постоянном объеме. Поэтому формула (102.10) может быть записана следующим образом:
есть теплоемкость киломоля при постоянном объеме. Поэтому формула (102.10) может быть записана следующим образом:
 (102.11)
(102.11)
Величина  есть приращение объема киломоля при повышении температуры на один градус при постоянстве давления. В соответствии с уравнением состояния
есть приращение объема киломоля при повышении температуры на один градус при постоянстве давления. В соответствии с уравнением состояния
V км = RT / p.
Отсюда при р = const:
 .
.
При подстановке в (102.11) получается:
C Р = C V + R. (102.12)
Таким образом, работа, которую совершает киломоль идеального газа при повышении его температуры на один градус при постоянном давлении, оказывается равной универсальной газовой постоянной. Отметим, что соотношение (102.12) получено с использованием уравнения состояния идеального газа и, следовательно, справедливо только для идеального газа.
С учетом формулы (102.7) можно получить для СР следующее выражение:
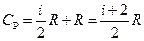 (102.13)
(102.13)
Поделив (102.13) на (102.7), найдем характерное для каждого газа отношение Ср к CV:
 (102.14)
(102.14)
Как следует из (102.14), величина g определяется числом и характером степеней свободы молекулы. В таблице 4 приведены значения CV, СР и g, получающиеся для различных молекул по формулам (102.7), (102.13) и (102.14). В таблице 5 сопоставлены результаты теории с экспериментальными данными. Теоретические значения получены (за исключением одного случая, указанного в примечании к таблице) в предположении, что молекулы являются жесткими; экспериментальные – получены для температур, близких к комнатной.


Как следует из таблицы 5, согласие между теорией и экспериментом на первый взгляд, во всяком случае для одно - и двухатомных молекул, оказывается вполне удовлетворительным. В действительности это не так. Согласно рассмотренной нами теории теплоемкости газов должны быть целыми, кратными R/2, ибо число степеней свободы может быть только целым. Поэтому даже малые отклонения Cv от значений, кратных R/2, играют принципиальную роль. Как видно из таблицы, такие отклонения, причем заведомо превышающие возможные погрешности измерений, имеют место.

|
Особенно разительными становятся расхождения между теорией и экспериментом, если обратиться к температурной зависимости теплоемкости. На рис. изображена кривая зависимости теплоемкости киломоля Cv, от температуры, полученная опытным путем для водорода. Согласно теории теплоемкость не должна зависеть от температуры [см. (102.7)]. Как видно из рисунка, это оказывается справедливым только в пределах отдельных температурных интервалов, причем в различных интервалах теплоемкость имеет значения, соответствующие различному числу степеней свободы молекулы.
Так, на участке 1 – 1' Cv равна (3/2)R. Это означает, что молекула ведет себя, как система, обладающая только поступательными степенями свободы. На участке 2 – 2' Cv = (5/2)R. Следовательно, при температурах, соответствующих этому участку, у молекулы, в дополнение к проявляющимся при более низких температурах трем поступательным степеням свободы, добавляются еще две вращательные. Наконец, при достаточно больших температурах Cv = (7/2)R, что свидетельствует о наличии при этих температурах колебаний молекулы. В промежутках между указанными интервалами теплоемкость монотонно растет с температурой, т. е. соответствует как бы нецелому переменному числу степеней свободы.
Таким образом, число степеней свободы молекулы, проявляющееся в теплоемкости, зависит от температуры. При низких температурах наблюдается только поступательное движение молекул. При более высоких температурах наряду с поступательным движением наблюдается также вращение молекул. И, наконец, при еще более высоких температурах к первым двум видам движения добавляются также колебания молекул. При этом, как следует из монотонного хода кривой теплоемкости, во вращательное, а затем в колебательное движение вовлекаются не сразу все молекулы. Сначала вращение, например, начинает наблюдаться только у небольшой доли молекул. С повышением температуры эта доля растет и в конечном итоге при достижении определенной температуры во вращательное движение будут вовлечены практически все молекулы. Аналогичный процесс имеет место и для колебательного движения молекул.
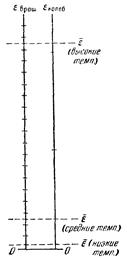
Объяснение такого поведения теплоемкости дается квантовой механикой. В соответствии с квантовой теорией, энергия вращательного и колебательного движений молекул квантована. Это означает, что энергия вращения и энергия колебания молекулы могут иметь не любые значения, а только дискретные (т. е. отдельные, отличающиеся друг от друга на конечную величину) значения. Следовательно, энергия, связанная с этими видами движения, может меняться только скачками. Для энергии поступательного движения такого ограничения не существует. Интервалы между отдельными допускаемыми значениями энергии (или, как принято говорить, между уровнями энергии) для колебаний примерно на порядок больше, чем для вращения. Упрощенная схема вращательных и колебательных уровней двухатомной молекулы дана на рисунке. Молекулы газа распределены по значениям энергии (больцмановский множитель!) таким образом, что подавляющая часть их обладает энергиями, близкими к среднему значению  , и лишь малая доля молекул имеет энергии, значительно превышающие
, и лишь малая доля молекул имеет энергии, значительно превышающие  . Поэтому, для того чтобы заметная доля молекул оказалась вовлеченной во вращательное или колебательное движение, их средняя энергия должна быть, достаточно велика по сравнению с расстоянием между дозволенными уровнями соответствующей энергии.
. Поэтому, для того чтобы заметная доля молекул оказалась вовлеченной во вращательное или колебательное движение, их средняя энергия должна быть, достаточно велика по сравнению с расстоянием между дозволенными уровнями соответствующей энергии.
|
Пусть температура столь низка, что средняя энергия молекулы  значительно меньше первого дозволенного значения энергии вращательного движения (см. нижнюю пунктирную прямую на рисунке). Тогда лишь незначительная часть всех молекул вовлекается во вращательное движение, так что практически молекулы газа будут двигаться только поступательно. Небольшие изменения температуры будут приводить к изменениям только энергии поступательного движения, в соответствии с чем, теплоемкость газа оказывается равной (3/2)R (см. участок 1 – 1'). Рост температуры соответствует возрастанию
значительно меньше первого дозволенного значения энергии вращательного движения (см. нижнюю пунктирную прямую на рисунке). Тогда лишь незначительная часть всех молекул вовлекается во вращательное движение, так что практически молекулы газа будут двигаться только поступательно. Небольшие изменения температуры будут приводить к изменениям только энергии поступательного движения, в соответствии с чем, теплоемкость газа оказывается равной (3/2)R (см. участок 1 – 1'). Рост температуры соответствует возрастанию  , вследствие чего все большая часть молекул вовлекается во вращательное движение. Этот процесс представлен участком кривой 1' – 2. После того как все молекулы будут вовлечены во вращательное движение, начнется горизонтальный участок 2 – 2'. При температурах, соответствующих этому участку,
, вследствие чего все большая часть молекул вовлекается во вращательное движение. Этот процесс представлен участком кривой 1' – 2. После того как все молекулы будут вовлечены во вращательное движение, начнется горизонтальный участок 2 – 2'. При температурах, соответствующих этому участку,  еще значительно меньше, чем расстояние между дозволенными уровнями колебательной энергии, вследствие чего колебания молекул практически будут отсутствовать. При дальнейшем повышении температуры молекулы начнут во все большем количестве вовлекаться в колебательное движение, чему соответствует переходный участок 2' – 3 на кривой теплоемкости. Наконец, при достаточно высокой температуре все молекулы окажутся вовлеченными в колебательное движение, в связи с чем, теплоемкость станет равной (7/2)R. Можно сказать, что результаты классической теории теплоемкости приблизительно верны для отдельных температурных интервалов, причем каждому интервалу соответствует свое число степеней свободы молекулы.
еще значительно меньше, чем расстояние между дозволенными уровнями колебательной энергии, вследствие чего колебания молекул практически будут отсутствовать. При дальнейшем повышении температуры молекулы начнут во все большем количестве вовлекаться в колебательное движение, чему соответствует переходный участок 2' – 3 на кривой теплоемкости. Наконец, при достаточно высокой температуре все молекулы окажутся вовлеченными в колебательное движение, в связи с чем, теплоемкость станет равной (7/2)R. Можно сказать, что результаты классической теории теплоемкости приблизительно верны для отдельных температурных интервалов, причем каждому интервалу соответствует свое число степеней свободы молекулы.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 8766; Нарушение авторских прав?; Мы поможем в написании вашей работы!