
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа. Адиабатически изолированная термодинамическая система
|
|
|
|
Лекция 11
Адиабатически изолированная термодинамическая система
Адиабатически изолированной термодинамической системой называют такую систему, в которой изменения её состояния могут происходить только благодаря механическим перемещениям частей оболочки (окружающих тел) и не могут происходить путём теплообмена с окружающими телами.
Изменение состояния адиабатически изолированной системы называют адиабатическим процессом, а оболочку, окружающую такую систему – адиабатической оболочкой.
Ещё в первой половине XIX в. Английский физик Дж.Джоуль экспериментально показал, что для адиабатического перехода термодинамической системы из определённого начального состояния в определённое конечное состояние всегда требуется одинаковая работа независимо от того, как осуществляется адиабатический переход.
Первое начало термодинамики для адиабатически изолированных систем имеет следующий вид:
Δ U 12 = U 2 – U 1 = A* 12 = – A 12.
Состояние термодинамического равновесия описывается набором параметров макросистемы, которые однозначно ему соответствуют.
Параметрами состояния макросистемы называют параметры, значения которых не зависят от того, каким образом система пришла в данное состояние. Для газа параметрами состояния являются давление, объём, температура, количество вещества, концентрация и др.
Зависимость между параметрами состояния макросистемы выражается уравнением состояния. Для газа уравнение состояния имеет форму
f (p, V, T, ν) = 0
Идеальным называют газ, уравнение состояния которого имеет вид
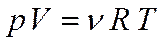 , где
, где
ν =  – количество вещества, измеряемое числом молей;
– количество вещества, измеряемое числом молей;
Моль – это количество вещества, содержащее число молекул, равное постоянной Авогадро N A = 6,022.1023 моль-1.
М – Молярная масса – масса одного моля, определяемая с помощью периодической системы элементов Менделеева.
R = 8,314 Дж/(моль.К) – универсальная газовая постоянная.
Это уравнение, называемое уравнением Клапейрона, является обобщением многочисленных экспериментальных данных, полученных для разных газов при температурах и давлениях близких к так называемым нормальным условиям (Т ~ 300 К, р ~ 100 кПа).
При нормальных условиях наиболее близкими по своим свойствам к идеальному газу являются водород и гелий.
Уравнение состояния идеального газа можно преобразовать следующим образом:
 , где
, где
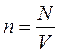 – концентрация газа (полное число молекул в единице объёма);
– концентрация газа (полное число молекул в единице объёма);
 = 1,38 . 10 –23 Дж/моль – постоянная Больцмана .
= 1,38 . 10 –23 Дж/моль – постоянная Больцмана .
В уравнении состояния идеального газа температуру Т называют абсолютной или термодинамической температурой, измеряемой в кельвинах (К – одна из основных единиц измерения в СИ, наряду с кг, м, с, моль).
По международному соглашению температурную шкалу строят по одной реперной точке, так называемой тройной точке воды – Т тр = 273,16 К. При таком значении Т тр интервал между точками плавления льда и кипения воды практически равен 100 кельвин.
В технике и быту часто пользуются шкалой Цельсия. Очень удобно, что 1 К = 1оС. Температура t по шкале Цельсия связана с температурой по шкале Кельвина равенством
t = T – 273,15.
Температуру Т = 0 называют абсолютным нулём.
При постоянном объёме V и количестве вещества ν температура Т пропорциональна давлению р идеального газа. Это означает, что если измерение температуры проводить с помощью газового термометра постоянного объёма, рабочим телом в котором является идеальный газ (идеально-газовый термометр), то такой термометр будет иметь линейную шкалу температур.
 Газовый термометр постоянного объёма состоит из термометрического тела – порции газа, заключённой в сосуд (1), который с помощью трубки (4) соединён с манометром (3). Измеряемая физическая величина (термометрический признак), обеспечивающая определение температуры, - давление газа при некотором фиксированном объёме. Постоянство объёма достигается тем, что вертикальным перемещением левой трубки манометра уровень в его правой трубке доводят до опорной метки (2) и измеряют разность высот уровней жидкости в манометре. Точность измерения температуры таким термометром при учёте различных поправок может достигать 0,001 К.
Газовый термометр постоянного объёма состоит из термометрического тела – порции газа, заключённой в сосуд (1), который с помощью трубки (4) соединён с манометром (3). Измеряемая физическая величина (термометрический признак), обеспечивающая определение температуры, - давление газа при некотором фиксированном объёме. Постоянство объёма достигается тем, что вертикальным перемещением левой трубки манометра уровень в его правой трубке доводят до опорной метки (2) и измеряют разность высот уровней жидкости в манометре. Точность измерения температуры таким термометром при учёте различных поправок может достигать 0,001 К.
Газовые термометры используют для градуировки других видов термометров (жидкостных, металлических, полупроводниковых, пирометрических, термопарных и т.д.).
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 982; Нарушение авторских прав?; Мы поможем в написании вашей работы!