
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газ Ван-дер-Ваальса
|
|
|
|
Работа газа при политропических процессах
Работу газа при любом процессе можно вычислять и при помощи первого начала термодинамики:
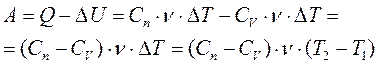
Из формулы 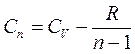 получаем
получаем 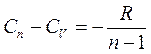 . Тогда работа газа в политропическом процессе:
. Тогда работа газа в политропическом процессе:
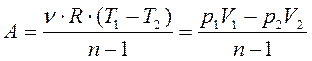 .
.
В изотермическом процессе вычислять работу по этой формуле не удобно так как в этом случае 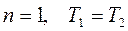 и А = 0/0. Поэтому в изотермическомпроцессе
и А = 0/0. Поэтому в изотермическомпроцессе
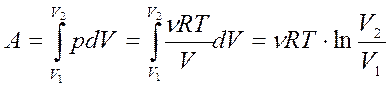 .
.
С ростом давления уравнение состояния идеального газа требует корректировки при описании поведения реальных газов. При р = 1000 атм (108 Па) произведение р.V становится вдвое больше, чем предписывает модель идеального газа для конкретной температуры (газ не «сжимается»).
Причин для такого отклонения две:
1) собственный размер молекул, уменьшающий объём, доступный для движения молекул (при нормальных условиях он составляет ~ 0,07% объёма сосуда с газом, а при 100 атм уже 70%);
 2) сложный характер взаимодействия между молекулами.
2) сложный характер взаимодействия между молекулами.
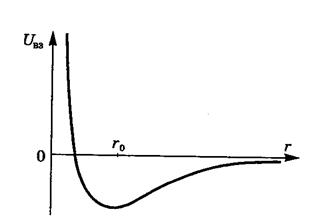
На рисунке приведена типичная кривая зависимости потенциальной энергии взаимодействия U ВЗ молекул от расстояния между их центрами.
На малых расстояниях (r < r o) молекулы отталкиваются, на больших (r > r o) притягиваются.
Для описания реального (неидеального) газа пользуются уравнением Ван-дер-Ваальса:
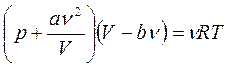 , где
, где
a и b – постоянные Ван-дер-Ваальса (для разных газов они имеют свои значения).
Поправка  обусловлена силами притяжения между молекулами. Она имеет размерность давления, и её иногда называют внутренним давлением.
обусловлена силами притяжения между молекулами. Она имеет размерность давления, и её иногда называют внутренним давлением.
Поправка b связана с собственным объёмом молекул.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 470; Нарушение авторских прав?; Мы поможем в написании вашей работы!