
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции. Оксилительно-восстановительные реакции(овр) – реакции, идущие с изменением степени окисления элементов
|
|
|
|
Оксилительно-восстановительные реакции(ОВР) – реакции, идущие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – процесс отдачи электронов; степень окисления при этом возрастает.
Восстановление – процесс присоединения электронов; степень окисления при этом уменьшается.
Окислители – вещества, которые восстанавливаются в ОВР. Типичные окислители: O2, галогены, HNO3, нитраты, H2SO4 конц, HClOx, их соли, KMnO4, K2Cr2O7, … (большинство соединений, в которых элемент проявляет максимальную степень окисления).
Восстановители – вещества, которые окисляются в ОВР. Типичные восстановители: металлы, С, СО, H2S, сульфиды, NH3, PH3, галогеноводороды, MnSO4, CrCl3, … (соединения с элементами, проявляющими низшую степень окисления).
Redox-амфолиты – соединения с окислительно-восстановительной двойственностью:
1. Соединения, содержащие элементы с промежуточной степенью окисления; в зависимости от второго участвующего в реакции вещества (с ярко выраженной природой окислителя или восстановителя) они по-разному ведут себя в ОВР:
а) неметаллы и их соединения, например:
H2S (у S-2 минимальная степень окисления) - восстановительные свойства;
S0; S+4 (SO2, H2SO3, сульфиты) – в ОВР redox-амфотерны
 ,
, 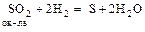 .
.
H2SO4 конц (у S+6 максимальная степень окисления) - окислительные свойства.
б) Соединения некоторых d – металлов

2. Водород пероксид H2O2
окислитель: 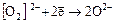 ,
,
восстановитель:  .
.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!