
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
IV. Влияние катализатора на скорость реакции
|
|
|
|
III. Влияние температуры на скорость реакции
Отражено в правиле Вант-Гоффа: при увеличении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2 - 4 раза:
 ,
,
где 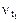 - скорость реакции при температуре t1,
- скорость реакции при температуре t1,  - скорость этой же реакции при температуре t2, g - температурный коэффициент, принимает значения 2, 3, 4 (реже 5).
- скорость этой же реакции при температуре t2, g - температурный коэффициент, принимает значения 2, 3, 4 (реже 5).
Пример:
Как изменится скорость реакции при повышении температуры с -10°С до +20°С, если температурный коэффициент = 3?
Решение:
 , откуда
, откуда 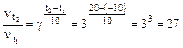 .
.
Ответ: скорость реакции возрастет в 27 раз.
Катализаторы - вещества, изменяющие скорость реакции, но не входящие в состав конечных продуктов. Катализ бывает:
а) положительный - если катализатор увеличивает скорость реакции;
б) отрицательный - если катализатор уменьшает скорость реакции (катализаторы в этом случае называют «ингибиторы»).
Химические реакции, протекающие в присутствии катализатора, называют «каталитические».
Если реагирующие вещества и катализатор находятся в одной фазе, то катализ гомогенный (гомо - однородный), если в различных фазах - гетерогенный (гетеро - разнородный).
Механизм действия катализаторов - образование промежуточных соединений:

Пример:
Нитрозный способ получения серной кислоты:
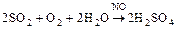

Вещества, снижающие активность твердого катализатора, - каталитические яды (это соединения Hg, Pb, цианиды и др.).
Энергия активации (Еакт) - та избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновения привели к образованию нового вещества. Такие молекулы называют «активные», с ростом температуры их число увеличивается и скорость реакции растёт.
Пример:

Разрыв старых связей и образование новых схематично можно изобразить:
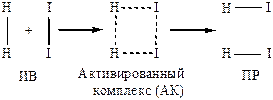
Энергетически продукты реакции(ПР) более выгодны, чем исходные вещества(ИВ):

С. Аррениус вывел термодинамическое уравнение зависимости константы скорости. от температуры с учётом энергии активации:
 ,
,
где Еакт – константа;
R – универсальная газовая постоянная;
Т – температура, град. К;
А – частотный множитель, доля числа столкновений между молекулами, которая заканчивается реакцией.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 668; Нарушение авторских прав?; Мы поможем в написании вашей работы!