
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Учение о растворах
Раствор - гомогенная равновесная система переменного состава, образованная из двух или более компонентов (ингредиентов).
Растворитель - среда, в которой растворенные вещества равномерно распределены в виде молекул или ионов.
Растворы часто занимают промежуточное состояние между механической смесью и химическим соединением.
Различия между раствором и химическим соединением:
1. состав раствора может варьироваться в очень широких пределах, а состав химического соединения неизменен;
2. из раствора можно выделять отдельные компоненты, не разрушая его однородности (с химическим соединением это невозможно).
Различия между раствором и простой механической смесью:
1. часто при растворении образуются сольваты или гидраты:
CuSO4 + 4H2O = [Cu(H2O)4] SO4;
2. при растворении может измениться цвет раствора по сравнению с растворяемым веществом;
3. растворение часто сопровождается эндотермическим или экзотермическим эффектом.
Из этого следует, что растворение – это физико-химический процесс, в котором играют роль физические и химические явления. Согласно физической теории, растворы рассматривают как смеси, образующиеся в результате измельчения растворяемого вещества в среде растворителя без непосредственного химического взаимодействия с ним. При этом большая роль отводится такому физическому явлению, как диффузия. Благодаря диффузии молекулы, ионы удаляются с поверхности ратворяющегося векщества и равномерно распределяются по всему объему растворителя. Из-за этого, при отсутствии перемешивания, быстрота растворения зависит от скорости диффузии.
Классификация растворов
1. По агрегатному состоянию:
а) Газообразные (воздух, воздушные смеси). В растворах газов, как и в индивидуальных веществах, находящихся в газообразном состоянии, наблюдается слабое взаимодействие между молекулами смешиваемых веществ. Для газового раствора характерно химическое движение молекул и отсутствие определенной геометрической структуры. Они находятся в виде химической смеси, каждому компоненту которой присущи индивидуальные физические и химические свойства. В качестве примера такой смеси можно привести воздух, состоящий из растворенных друг в друге азота, кислорода, углекислого газа, инертных и др. газов, паров воды и некоторых твердых микрочастиц (которые называют пылью).
б) Твердые (сплавы, таблетки, пища). Они представляют собой однородные крисьталлы, образующиеся, как правило, из металлов. При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же рнастворимы друг в друге лишь до определенной концентрации. Для получения твердого раствора проводят охлаждение расплава, что сопровождается, как правило, выпадением кристаллов.
в) Жидкие (плазма крови, лимфа, речная и морская вода, микстуры). Они обладают внутренней структурой, которая при больших разбалениях близка к структуре растворителя, а в концентрированных растворах – растворенного вещества. Этот тип растворов наиболее распространен.
2. По физическим свойствам (например электропроводность):
а) неэлектролиты (раствор глюкозы);
б) электролиты (физиологический раствор).
3. По размеру частиц:
a) истинные растворы (растворенные вещества находятся в растворе в виде молекул или ионов);
признаки: (1) прозрачны;
(2) устойчивы при хранении;
(3) диаметр частиц < 1 ммк.
б) коллоидные растворы (растворенные вещества в виде сложных агрегатов);
признаки: (1) при прохождении света через раствор специфично рассеивают его, образуя конус Тиндаля;
(2) при хранении разрушаются;
(3) диаметр частиц лежит в интервале 1 - 100 ммк
в) дисперсные системы (взвеси)
существуют в виде эмульсий или суспензий;
признаки: (1) непрозрачны;
(2) неустойчивы;
(3) диаметр частиц > 100 ммк
4. По количеству растворенных частиц:
a) насыщенные (устойчивы - имеет место равновесие между раствором и твердым веществом); ∆G = 0.
б)ненасыщенные; ∆G < 0.
в)пересыщенные. ∆G > 0; система неустойчива, при встряхивании из них образуются насыщенные растворы и выделяется избыток растворённого вещества.
Растворимость газов
Этот процесс можно рассматривать:
1) либо как механический процесс (действие сил Ван-дер-Ваальса) – например при растворении в воде Н2 , О2 , N 2, инертных газов;
2)либо как химическое взаимодействие
(NH3 + H2O = NH4OH; Cl2 + H2O = HCl + HClO).
Растворимость газов зависит от нескольких факторов:
1. От давления по закону Генри – масса газа, растворяющегося в данном объёме жидкости при постоянной температуре, прямо пропорциональна его парциальному давлению:
mгаза = k × P,
где m – масса газа в растворе;
k – константа пропорциональности;
Р – парциальное давление.
2. От температуры – чем выше температура, тем хуже растворяется газ.
3. От наличия в растворе других веществ по закону И.М. Сеченова (был выведен при подсчёте кислородной ёмкости крови) – на растворимость газов в жидкости влияют другие вещества:
 ,
,
где  - растворимость газа в чистом растворителе;
- растворимость газа в чистом растворителе;
 - растворимость газа в растворе соли;
- растворимость газа в растворе соли;
 - концентрация соли в растворе;
- концентрация соли в растворе;
 - константа Сеченова, положительная величина.
- константа Сеченова, положительная величина.
Анализ формулы показывает, что всегда 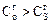 .
.
Растворимость жидких и твёрдых веществ
1. Как правило не зависит от давления, потому что при смешивании жидкостей объем меняется незначительно и может измениться только при давлении в несколько тысяч атмосфер;
2. Как правило это эндотермический процесс: при повышении температуры растворимость возрастает, так как энергия затрачивается на разрушение кристаллической решетки и равномерное распределение молекул (ионов) по всему объему раствора.
3. Если же при растворении выделяется теплота, то следовательно в растворе образуются сольватные частицы (если растворитель – вода, то чакстицы называют гидратными) и процесс будет экзотермическим.
|
|
Дата добавления: 2015-05-26; Просмотров: 546; Нарушение авторских прав?; Мы поможем в написании вашей работы!