
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста
|
|
|
|
Типы окислительно-востановительных реакций
I. Межмолекулярные – окислитель и восстановитель находятся в виде различных веществ.
1) окислитель + восстановитель ®
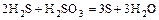
2) реакции в растворах; велико значение среды, которая влияет на продукты реакции (кислая, нейтральная, щелочная):
а) 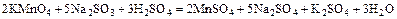 ;
;
б) 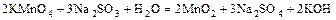 ;
;
в) 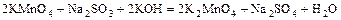 .
.
3) Иногда одно и то же вещество одновременно является средой и окислителем или средой и восстановителем:
а) 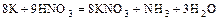 ,
,
( - окислитель и среда);
- окислитель и среда);
б) 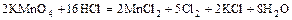 ,
,
(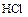 - восстановитель и среда).
- восстановитель и среда).
II. Внутримолекулярные
1. В одной и той же молекуле меняется степень окисления у атомов разных элементов:
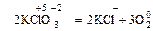 .
.
2. Разложение веществ, в которых атомы одного и того же элемента имеют разные степени окисления:
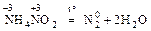
III. Самоокисление – самовосстановление (диспропорционирование)
 .
.
Позволяет количественно оценить интенсивность протекания ОВР:
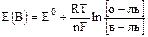 ,
,
где R – универсальная газовая постоянная, = 8,314 Дж/моль×К;
Т – температура, град. К;
F – постоянная Фарадея, 96500 Кл;
n – число электронов, участвующих в реакции;
Е0(В) – стандартный электродный потенциал, величина табличная, его измеряют для одномолярного раствора окислителя или восстановителя при температуре 20°С как разность потенциалов по отношению к водородному электроду
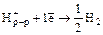 .
.
Сравнение величин Е0 для двух пар окислитель/восстановитель позволяет определить направление реакции: чем больше значение Е0, тем более сильным будет окислитель и именно с этим окислителем будет протекать ОВР.
Пример: какая из реакций более вероятна:
(1) 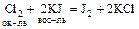 или
или
(2) 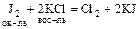 ?
?
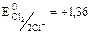 В
В 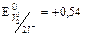 В.
В.
Т.к. 1,36 В > 0,54 В, то 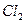 будет более сильным окислителем, чем
будет более сильным окислителем, чем 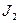 и следовательно пойдёт реакция (1).
и следовательно пойдёт реакция (1).
В живых и растительных организмах ОВР необходимы для синтеза жизненно важных кислородных органических биомолекул: углеводов, жирных кислот, гормонов и др. Здесь наиболее значимы процессы окисления в митохондриях. С помощью окислительно-восстановительных реакций в организме распадаются токсичные вещества, как образующиеся в ходе метаболизма, так и попавшие в него извне.
Сильные окислители (KMnO4, H2O2, J2-спиртовый раствор, хлорная известь и др.) используются в медицинской и гигиенической практике в качестве дезинфицирующих средств.
В количественном химическом анализе нашли широкое применение методы, в основе которых лежат окислительно-восстановительные реакции. Раздел «оксидиметрия» включает в себя методы «перманганатометрия», «иодиметрия», «бромометрия», «броматометрия» и др., которые широко используются для установления подлинности фармпрепаратов, их степени чистоты и идентификации многих синтезированных или выделенных из растительного сырья лекарственных средств.
Вопросы для закрепления материала:
1.Какое вещество проявляет максимальные окислительные свойства – а)NH3? б)KNO3? в)HNO2?
2.Характерны ли восстановительные свойства для МпО2?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 436; Нарушение авторских прав?; Мы поможем в написании вашей работы!