
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II. Зависимость скорости реакции от концентраций реагирующих веществ
|
|
|
|
I. Зависимость скорости реакции от природы реагирующих веществ
Скорость химических реакций
Скорость реакции (n, моль/л×сек) - изменение концентрации вещества в единицу времени.
Пусть с1 – концентрация какого-либо вещества в момент времени t1;
с2 - концентрация этого же вещества в момент времени t2.
Тогда
 .
.
Так как n постоянно меняется, то обычно берут истинную скорость реакции (т.е. в данный момент времени):
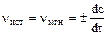 .
.
Скорость реакции зависит от разных факторов.
Пример:
Железо окисляется до окалины, этот процесс выражается уравнением
3Fe + 2О2 ® Fe3O4
Условия протекания реакции могут быть различными:
а) окисление кислородом воздуха протекает со скоростью n1;
б) окисление чистым кислородом - со скоростью n2;
в) окисление озоном - со скоростью n3.
В случае «в» окисление идет быстрее всего, и для данного примера можно записать ряд: n3 > n2 > n1.
Закон действующих масс - основной закон химической кинетики: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
1) Рассмотрим процесс А +В Û С. Чем больше столкновений между молекулами А и В, тем быстрее идет реакция. А столкновений тем больше, чем больше концентрации (са и сB).
Тогда nпрям реакции = k1 са сB и no6p реакции = k2 сс, где
k1 и k2 - коэффициенты пропорциональности или константы скорости прямой и обратной реакций (k1 = nпрям реакции, если са = сB = 1 моль/л; k2 = no6p реакции, если сс = 1 моль/л).
2) Для более сложного процесса с участием коэффициентов типа
nA + mB Û pC + qD:
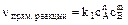 ;
; 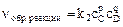 .
.
3). Если в реакции участвуют вещества в различном агрегатном состоянии, то в окончательном варианте учитывают только концентрации газообразных веществ (т.к. они несоизмеримо больше, чем концентрации жидких или твердых веществ):
Fe3O4(TB) + 4Н2 (газ) Û 3Fe (TB) + 4Н2О(газ)
 ;
;
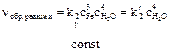
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 591; Нарушение авторских прав?; Мы поможем в написании вашей работы!