
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Искусственная вентиляция лёгких при операциях на трахее и бронхах
|
|
|
|
П
на начальном этапе операции он находится в умеренных пределах от 2 до 2,5 мл/кг, что совпадает с наблюдениями Н.Е.Хорохордина и соавт. (1989).
Сохранение двулегочной вентиляции на основном этапе операции целесообразно не только для создания «хирургического комфорта» для оператора, но и для предотвращения негативных последствий продолжающейся вентиляции оперируемого лёгкого. Механическая травма вентилируемого лёгкого при выполнении на нем хирургических манипуляций вызывает выраженные нарушения легочной гемодинамики и метаболизма лёгких, увеличение нагрузки на правые и левые отделы сердца, повреждение сурфактантной системы, не менее выраженные, чем при коллапсе этого лёгкого [Выжигина М.А., 1996].
При использовании традиционной ИВЛ приходится выключать независимое легкое из вентиляции. Хотя большинство больных переносят кратковременный (до 30 мин) коллапс лёгкого без развития тяжелых расстройств гомеостаза, тем не менее при FpO2 = 0,3 наступают ухудшение газообмена и депрессия кровообращения [Выжигина М.А. и соавт., 1985]. Ра(>2 снижается до 70 мм рт. ст. и ниже, увеличивается объем внут-рилегочного шунтирования до 40—50 % сердечного выброса [Долина О.А., 1975; Малышев В.Д., 1989]. Заслуживает внимания тот факт, что даже при небольшом снижении сердечного выброса происходит интенсивное (до 4 мл/кг) накопление жидкости в интерстициальном пространстве лёгких. Этот процесс лежит в основе развития осложнений во время операции и в послеоперационном периоде в виде дыхательной и легочно-сер-дечной недостаточности [Obdrzalek S. et al., 1979; Seibold H. et al., 1979]. Накопление жидкости в интерстициальном легочном пространстве более чем вдвое по сравнению с исходной величиной является серьезным препятствием для оксигенации [Staub N. S., Hogg S.C., 1980; Симио Нитта, 1989].
Увеличение FrO2 до 1,0 за счет исключения закиси азота из состава вдыхаемой смеси во время внутривенной анестезии не только не корригирует накопление жидкости в интерстициальном пространстве лёгких, но и даже усугубляет его. Объем общей внесосудистой жидкости увеличивается до 5—6 мл/кг. Возможно, сказывается повреждающее воздействие высокой концентрации кислорода на проницаемость сосудов микроцир-куляторного русла малого круга кровообращения [Выжигина М.А., 1995]. Однако при продолжительности однолегочной вентиляции не более 1 ч сердечный выброс не снижается, сохраняется хорошая оксигенация артериальной крови. Объем внут-рилегочного шунта не становится меньшим, чем при использовании в составе дыхательной смеси закиси азота [Выжигина М.А. и др., 1986, 1989; Бунятян А.А. и др., 1989].
Исключительно важную роль в коррекции описанных изме-
нений гемодинамики и газообмена сыграло применение ВЧ ИВЛ. Для вентиляции независимого лёгкого мы использовали JB4 ИВЛ в сочетании с традиционной ИВЛ зависимого лёгкого (дифференцированная ИВЛ). При этом ВЧ вентиляцию независимого лёгкого проводили с частотой от 100 до 400 циклов в минуту при рабочем давлении от 0,1 до 0,5 кгс/см2 и отношении вдох: выдох 1: 1 и 1: 2. В этих условиях легкое было слегка расправлено, сохраняло розовый цвет в отличие от синюшно-фиолетового цвета коллабированного лёгкого. Дыхательные движения лёгкого были минимальными, оно занимало незначительный объем в плевральной полости и не мешало работе хирургов, которые отмечают, что чем выше частота дыхательных движений, тем менее подвижно легкое. При увеличении частоты дыхания до 400 циклов в минуту легкое практически «стоит», податливость его улучшается. Коллабированное легкое более чувствительно к случайным травмирующим воздействиям, чем расправленное при ВЧ ИВЛ. Хирурги положительно оценили замену полного коллабирования независимого лёгкого его высокочастотной вентиляционной поддержкой. Этот прием обеспечивает снижение объема внутрилегочного шунтирования до 13—20 % сердечного выброса. В наших наблюдениях объем общей внесосудистой жидкости в лёгких уменьшался до минимальных значений: 1—1,5 мл/кг. Одновременно повышались РаОз (до 250—300 мм рт.ст.) и сердечный выброс (до 7,5—8,5 л/мин).
Избыточная оксигенация крови при этой модификации дифференцированной ИВЛ позволяет использовать для традиционной вентиляции зависимого лёгкого закись азота с кислородом с FjO2 = 0,3. При этом РаО2 приближается к оптимальной величине 120—140 мм рт.ст., но сохраняется наиболее существенное преимущество дифференцированной вентиляции лёгких — эффективный газообмен и низкий объем внесосудистой жидкости в лёгких (2—2,5 мл/кг).
Реализация дифференцированной ИВЛ предполагает применение двухпросветных трубок для разделения дыхательных каналов обоих лёгких. К каналу интубационной трубки, ведущему в независимое легкое, присоединяют инжектор аппарата ВЧ ИВЛ либо в него вводят катетер для подачи кислорода при необходимости повышения FiO2- Другой канал соединяют с адаптером объемного аппарата, например РО-6Н. Очень важно, чтобы трахеальная манжета интубационной трубки была коллабирована, бронхиальная же, введенная в главный бронх зависимого лёгкого, наоборот, расправлена.
Помимо того что дифференцированная вентиляция лёгких имеет чисто функциональные преимущества в торакальной хирургии, метод целесообразно применять также при наличии абсолютных показаний к разделению дыхательных каналов
(легочное кровотечение, бронхоэктазы, абсцесс лёгкого) как с целью поддержания адекватной оксигенации, так и для санации пораженного лёгкого, которая улучшается в результате экспульсивного эффекта ВЧ ИВЛ.
В тех случаях, когда интубация двухпросветной трубкой невыполнима (особенности анатомического строения дыхательных путей больного, отсутствие анестезиолога, владеющего приемами интубации двухпросветными трубками и имеющего навыки в её проведении), можно использовать высокочастотную вентиляцию обоих лёгких через однопросветную интубационную трубку, установленную в трахее [Выжигина М.А. и др., 1989]. Этот способ ВЧ ИВЛ может быть применен в хирургии лёгких, если нет опасности массивной аспирации содержимого из пораженного лёгкого в здоровое при положении больного на здоровом боку во время оперативных вмешательств. В противном случае интубационную трубку следует сразу продвинуть в главный бронх зависимого лёгкого и проводить однолегочную ИВЛ.
Высокочастотная вентиляция обоих лёгких, как инжекци-онная, так и катетерная, обеспечивает надежные и стабильные газообмен и гемодинамику. Объем внутрилегочного шунтирования при ней минимален (17—20 % от сердечного выброса) даже при выполнении травматических хирургических манипуляций на оперируемом легком. Объем общей внесосудистой жидкости в лёгких такой же, как и при дифференцированной ИВЛ, — 2,5—3 мл/кг, сердечный выброс 6—7 л/мин. Однако ВЧ ИВЛ через однопросветную трубку не получила широкого распространения при операциях на лёгких и органах средостения из-за необходимости применять значительно большее рабочее давление, чем при дифференцированном режиме ИВЛ (0,8—1,0 кгс/см2) для поддержания достаточного газообмена. В этих условиях независимое легкое сильно перераздувается в отличие от зависимого, ограниченного пределами плевральной полости, что затрудняет действия оперирующих хирургов.
При необходимости проведения ВЧ ИВЛ зависимого лёгкого в сочетании с коллапсом оперируемого, что чаще всего требуется при операциях на главных бронхах, следует учитывать некоторые её особенности в сравнении с традиционной одно-легочной вентиляцией. Содержание жидкости в интерстици-альном пространстве лёгких при однолегочной ВЧ ИВЛ — 2,5—3,5 мл/кг — ниже, чем при её традиционном варианте, но значительно возрастает объем венозного шунтирования — до 50 % сердечного выброса. Оксигенация артериальной крови и сердечный выброс при этом такие же, как при традиционной однолегочной ИВЛ с использованием гипероксической дыхательной смеси, однако нарушается элиминация углекислоты, в связи с чем происходит её постепенное накопление.
Однако существует и другая точка зрения. Так, Б.Д.Зислин
(1990) считает, что однолегочная ВЧ ИВЛ зависимого лёгкого при коллапсе независимого имеет право на существование. По данным автора, при этом методе газообмен и гемодинамика соответствуют таковым при двулегочной ВЧ ИВЛ, артериальная гипоксемия не наблюдается и внутрилегочный шунт не превышает 11 % от сердечного выброса.
При использовании такого варианта обеспечения газообмена применение закиси азота, естественно, исключается. Авторы показали, что для внутривенной анестезии в этих условиях целесообразно использовать промедол, фентанил и сомбревин, поскольку неблагоприятные гемодинамические изменения, в частности гипердинамические реакции кровообращения, выражены значительно меньше, что может иметь значение у больных с сопутствующей сердечной патологией [Зислин Б.Д. и др., 1990].
Совершенно очевидно, что при однолегочной ВЧ ИВЛ зависимого лёгкого, так же как и при традиционной однолегочной вентиляции, сохраняются все негативные последствия коллапса оперируемого лёгкого: повышенная хрупкость и повреждаемость ткани лёгкого в условиях механических воздействий, более выраженные повреждения сурфактанта, что, как правило, становится причиной послеоперационных осложнений в системе дыхания. У ряда больных функциональная несостоятельность зависимого лёгкого, исходная сердечная недостаточность являются противопоказанием к выключению из вентиляции независимого лёгкого. Возможность исключить с помощью ВЧ ИВЛ'коллабирование оперируемого лёгкого является, по-видимому, наиболее существенным преимуществом метода ВЧ ИВЛ в хирургии лёгких. Этот метод также во многом помог решить проблему обеспечения адекватного газообмена при негерметичности нижних отделов дыхательных путей при операциях на лёгких.
Изучение гемодинамических эффектов вариантов ИВЛ с использованием высокочастотных методик позволяет подчеркнуть, что они создают более благоприятные условия для кровообращения в сравнении с традиционной ИВЛ. Результаты наших наблюдений совпадают с данными многих исследователей, свидетельствующими о весьма существенной роли сердечного выброса в поддержании адекватного РаО£ во время ИВЛ. В эксперименте на животных с открытой грудной клеткой было показано достоверное снижение сердечного выброса при традиционной ИВЛ [Clowes G.H. et al., 1960; Modell H., Milkorn В., 1972, и др.], что объясняют снижением венозного возврата либо повышением ре-зистентности легочной сосудистой сети [Caldini P. et al., 1963]. При ВЧ ИВЛ, наоборот, не создается высокого РПИю не нарушаются условия для венозного возврата, что способствует стабилизации сердечного выброса, а также не деформируются микрососуды лёгкого (как это происходит при традиционной ИВЛ) и не нарушается приток крови к ним [Выжигина М.А. идр., 1995]. Этосу-
щественно улучшает условия газообмена, чем и определяется высокая оксигенирующая способность ВЧ ИВЛ. Наибольшую стабильность параметров кровообращения и артериальной ок-сигенации обеспечивает дифференцированная вентиляция лёгких с использованием ВЧ ИВЛ оперируемого и традиционной ИВЛ контралатерального лёгкого.
Уменьшение объема общей внесосудистой жидкости в лёгких во время ВЧ ИВЛ, по-видимому, является следствием ПДКВ, характерного для ВЧ ИВЛ. Умеренное ПДКВ (не более 4—5 см вод. ст.), присущее применяемым нами режимам ВЧ ИВЛ, препятствуя увеличению емкости интерстициального пространства лёгких, в то же время не нарушает эффективной микроциркуляции в перибронхиальных венозных сплетениях и лимфотока, которые являются основными интерстициальны-ми дренажными коллекторами лёгких [Симбирцев С.А. и др., 1989; Симио Нитта, 1989; Martin V. et al., 1984; Staun N.S. et al., 1980]. В связи с тем что венозные капилляры не спадаются при давлении до 18 см вод.ст., отсутствие традиционных пиков давления на вдохе при ВЧ ИВЛ, по-видимому, является наиболее щадящим вентиляционным режимом для капиллярного сосудистого русла лёгких. J.Kudoh и соавт. (1987) отмечают как положительное явление также вибромассаж микрососудистого русла лёгких при высокочастотном способе ИВЛ.
Показания к проведению дифференцированной вентиляции лёгких с использованием ВЧ ИВЛ:
— необходимость исключить коллабирование независимого лёгкого во время оперативного вмешательства на органах грудной клетки;
— негерметичность паренхимы лёгкого или наличие бронхиальной фистулы;
— резкое снижение резервов дыхания и кровообращения, правожелудочковая сердечная недостаточность.
Дифференцированная ИВЛ особенно показана больным с легочным сердцем и нарушением оксигенирующей функции лёгких. •-,
Операции на трахее и бронхах предъявляют ряд требований к анестезиологическому обеспечению, среди которых специфичным является необходимость поддержания эффективного газообмена в условиях длительного широкого вскрытия просвета дыхательных путей. При этом, естественно, нарушается герметизм дыхательного контура и традиционная ИВЛ становится невозможной. *...••.
Наличие эндотрахеальной (эндобронхиальной) трубки в дыхательных путях при большинстве вмешательств на трахее и её бифуркации нежелательно: в этом случае затрудняются действия хирургов и увеличивается продолжительность операции. Введение интубационной трубки в дистальные отрезки дыхательных путей со стороны операционного поля ухудшает условия для резекции и адаптации анастомозируемых отрезков дыхательных путей, резко ограничивает действия хирургов. В связи с этим интубационную трубку периодически извлекают из просвета трахеи или бронха и выполняют хирургические манипуляции в условиях апноэ различной продолжительности, что неизбежно приводит к нарушению газового и метаболического меостаза [Петровский Б.В. и др., 1978; Выжигина М.А. и др., 1986, 1987].
Пытаясь решить проблему поддержания газообмена при неэффективной традиционной ИВЛ, ряд авторов предлагал проводить операции на дыхательных путях в условиях гипербарической оксигенации [Перельман М.И. и др., 1983; Выжигина М.А. и др., 1988], умеренной гипотермии [Brewer L., 1965; Simone M., 1967], с использованием экстракорпоральной оксигенации [Перельман М.И. и др., 1976; Stalpaert G. et al., 1979; Haberer G. et al., 1980] и перфузии гомологичных лёгких [Сергиевский B.C., 1972;СемашковВ.Т. и др., 1975].
Принципиально проблема вентиляции лёгких при операциях, требующих длительного широкого вскрытия просвета дыхательных путей, была впервые решена в 1959 г. P.Gebauer — создателем метода «шунт—дыхание». Он заключался в интубации дистального отрезка трахеи или бронха со стороны вскрытой плевральной полости второй интубационной трубкой, вводимой через дополнительный разрез трахеи. С тех пор метод «шунт—дыхание» стал доминирующим способом обеспечения газообмена при резекции и реконструкции трахеи [Цибу-ляк В.Н., Трусов B.C., 1973; Выжигина М.А., 1986, 1987; Bjork V. et al., 1972, и др.]. Нами разработаны варианты интра-раневой интубации дистальных отрезков дыхательных путей при различных видах трахеобронхиальных резекций (рис. 16.2). Однако все эти методы, требующие специальной технической оснащенности и неудобные для хирурга, оказались ненужными после внедрения в комплекс анестезиологического пособия метода струйной ВЧ ИВЛ. Не будет преувеличением, если мы скажем, что ни в одной области медицины ВЧ ИВЛ не оказалась столь незаменимой, как в хирургии трахеи и бронхов.
При оперативном вмешательстве по поводу стеноза трахеи ВЧ ИВЛ была впервые применена I.Eriksson (1975). В настоящее время её широко используют при операциях на дыхательных путях [Зислин Б.Д., 1986; Бунятян А.А., Выжигина М.А., 1995, 1996].
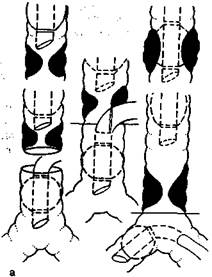
Рис. 16.2. Варианты введения инту-бационной трубки для способа «шунт—дыхание».
а — на этапах линейной резекции и реконструкции трахеи; б — на этапах резекции трахеи и правосторонней пневмонэктомии; в — на этапах резекции бифуркации трахеи с оставлением левого лёгкого в состоянии ателектаза.
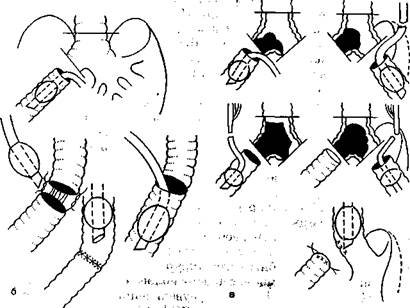
В условиях нарушенной целостности нижних отделов дыхательных путей и в отсутствие герметизма дыхательного контура ВЧ ИВЛ осуществляют через тонкий пластмассовый катетер, вводимый в дистальный отрезок трахеи или главного бронха. Небольшой диаметр катетера позволяет выполнять хи-
рургические манипуляции, не извлекая его из просвета дыхательных путей, т.е. не прерывая вентиляцию и не затрудняя при <этом работу хирурга. Диаметр катетера зависит от размера дыхательных путей больного. Обычно используют катетер с внутренним диаметром 3 мм. Шведская фирма «Medata» поставляет специально разработанные катетеры с одним торцовым и четырьмя боковыми отверстиями. Поток газа через боковые отверстия выталкивает кровь и фрагменты тканей в краниальном направлении, предупреждая, таким образом, их аспирацию и последующие респираторные осложнения. Однако принципиально можно использовать любой пластмассовый катетер подходящего диаметра, например применяемый для ангиографии.
Перед операцией анестезиолог должен внимательно ознакомиться с особенностями патологии трахеи и бронхов на основании клинических, рентгеновских и бронхологических данных, а затем обсудить и согласовать с хирургом (!) план операции, возможные варианты анестезии, интубации и способы ИВЛ с учетом особенностей каждого этапа операции. При значительной обструкции дыхательных путей необходимо избегать глубокой седации и тем более депрессии дыхательного центра из-за высокого риска развития ОДН. У больных с выраженной обструкцией и стридором, когда в дыхании принимают участие вспомогательные мышцы, противопоказано назначение атропина и других препаратов, угнетающих секрецию, так как они создают условия для образования пробок из бронхиального секрета, которые располагаются в месте сужения и могут привести к почти полной закупорке воздухоносных путей.
В анестезиологическом обеспечении операций на трахее и бронхах важнейшая роль принадлежит созданию методик тотальной внутривенной анестезии, позволяющих исключить закись азота из состава дыхательной смеси и использовать для ИВЛ гипероксические газовые смеси.
Наличие у больного стридора и декомпенсации дыхания во время операции, выполняемой в связи с обструкцией дыхательных путей опухолью либо Рубцовым процессом, диктует необходимость применения гипероксической смеси с самого начала общей анестезии. Во всех других случаях мы использовали «альтернирующую» методику обезболивания [Бунятян А.А. и др., 1986,1989].
Введение в наркоз и интубация — очень опасный и ответственный этап анестезии в хирургии трахеи. Он одинаково сложен при операциях как на шейном, так и на грудном отделах трахеи. Потенциальные опасности этого периода требуют присутствия в операционной полностью подготовленного к выполнению вмешательства оперирующего хирурга.
Индукцию в анестезию проводят путем последовательного введения 10—20 мг седуксена, 100—200 мл 0,1 % раствора кетамина в изотоническом растворе хлорида натрия со скорос-
тью 20 мл/мин (либо тиопентала натрия или гексенала 1,5— 2 мг/кг), 0,2—0,3 мг фентанила или 10—15 мг дипидолора.
Во время традиционной ИВЛ анестезию поддерживают с помощью закиси азота, а при ВЧ ИВЛ — внутривенной инфу-зии 0,1 % раствора кетамина со скоростью 1—4 мг/кг в час в сочетании с введением фентанила (0,1—0,2 мг) или дипидолора (5—15 мг), дроперидола (2,5—7,5 мг), павулона (ардуана) (0,06—0,09 мг/кг) или тубарина (0,4—0,5 мг/кг).
В настоящее время при опухолях трахеи с целью профилактики осложнений мы выполняем предварительную предоперационную лазерную деструкцию опухолевой массы в просвете трахеи в условиях ВЧ ИВЛ.
Начальный и заключительный этапы операции обычно выполняют с применением традиционной ИВЛ через эндотрахеальную интубационную трубку, а на основном этапе операции, когда необходимо длительное широкое вскрытие просвета дыхательных путей, проводят ВЧ ИВЛ. Попеременное использование интуба-ционных трубок и инсуффляционных катетеров на фоне чередования методов анестезии — ингаляционной, N20 + qz (2:1) и внутривенной кетаминовой — предотвращает развитие интра- и послеоперационной дыхательной недостаточности при операциях на трахее и главных бронхах [Бунятян А.А. и др., 1988].
С целью обеспечения эффективной оксигенации и удаления углекислого газа на этапах операции, связанных с вскрытием просвета нижних отделов дыхательных путей, ВЧ ИВЛ проводят при частоте 100—200 циклов в минуту, рабочем давлении 3—3,5 кгс/см2, отношении вдох: выдох 1:2 — 1:1.
ВЧ ИВЛ осуществляют по-разному в зависимости от уровня и вида резекции, плана и особенностей выполнения операции. При резекции и реконструкции трахеи катетер для ВЧ ИВЛ проводят в нижележащие отделы дыхательных путей двумя основными способами:
1) через интубационную трубку;
2) со стороны операционного поля в дистальные отрезки трахеи или бронхов.
Например, при операциях на шейном и грудном отделах трахеи в период резекции и наложения задних швов анастомоза катетер вводят через интубационную трубку сквозь операционное поле в дистальный отрезок трахеи (рис. 16.3,а).
При этом следует иметь в виду, что при крайних степенях стеноза катетер может практически полностью обтурировать оставшийся просвет трахеи и создать препятствие выдоху. В связи с этим рекомендуется проводить катетер через интубационную трубку и область стеноза только после вскрытия просвета трахеи ниже препятствия [Chiaranda M., Giunta P., 1984]. В период формирования передних швов анастомоза ка-
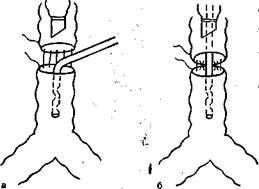
Рис. 16.3. Последовательность введения катетеров для ВЧ ИВЛ при операциях на шейном и грудном отделах трахеи.
а — при наложении швов на заднюю стенку анастомоза; б — на переднюю стенку анастомоза.
тетер для ВЧ ИВЛ может быть введен в дистальный отрезок трахеи через интубационную трубку (рис. 16.3,6).
При выполнении операции линейного протезирования шейного или грудного отдела трахеи во время резекции и наложения дистального анастомоза ВЧ ИВЛ проводят через катетер, введенный в отрезок трахеи со стороны операционного поля. При формировании проксимального анастомоза катетер вновь вводят со стороны интубационной трубки через просвет протеза в дистальный отрезок трахеи и проводят ВЧ ИВЛ обоих лёгких.
При операции на надбифуркационном отделе трахеи на этапе резекции пораженного участка и при наложении задних швов анастомоза катетеры вводят через эндотрахеальную интубационную трубку либо со стороны операционного поля и проводят их в главные бронхи обоих лёгких. В последнем случае на заключительном этапе при наложении швов на переднюю стенку анастомоза вентиляционные катетеры снова проводят через интубационную трубку сквозь операционное поле в главные бронхи обоих лёгких. Таким образом, на всех этапах основного периода операции выполняют ВЧ ИВЛ обоих лёгких, что обеспечивает оптимальное состояние газообмена и кровообращения.
Наиболее сложным представляется проведение ВЧ ИВЛ при операциях на бифуркации трахеи. По данным H.Korkenrant (1987), H.Koga (1986) и нашим наблюдениям, длительная высокочастотная однолегочная вентиляция сопровождается развитием гиперкапнии. В связи с этим мы разработали варианты введения вентиляционных катетеров, обеспечивающие высокочастотную вентиляцию обоих лёгких на всех этапах резекции и реконструкции либо протезирования бифуркации трахеи. При
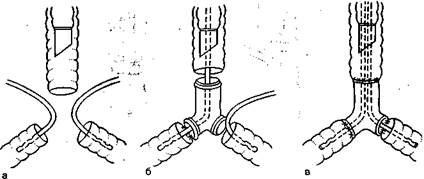
Рис. 16.4. Последовательность введения катетеров для ВЧ ИВЛ при протезировании бифуркации трахеи (вид сзади).
а — на этапе резекции; б — на этапе наложения анастомоза левого главного бронха с левой браншей протеза; в — на этапе наложения анастомоза правого главного бронха с правой браншей протеза.
.*•,}.!.' •'•».'',;^Н ,iif-t ¥,.<,-,,.••..:*-•.,-•-
резекции и реконструкции либо протезировании бифуркации трахеи для вентиляции обоих лёгких используют одновременно два катетера, соединенных с двумя аппаратами ВЧ ИВЛ. Чередование и последовательность введения каждого из катетеров определяются этапом операции и последовательностью наложения трахеальных анастомозов. Чаще всего на этапе резекции катетеры для ВЧ ИВЛ вводят в дистальные отрезки главных бронхов со стороны операционного поля (1-й этап ВЧ ИВЛ; рис. 16.4,а), а при формировании трахеальных и трахео-бронхиальных анастомозов вновь поочередно вводят через ин-тубационную трубку, проводят сквозь просветы анастомозиру-емых дыхательных путей или просветы браншей протеза в главные бронхи обоих лёгких (2-й и 3-й этапы ВЧ ИВЛ; рис. 16.4,6 и в).
ВЧ ИВЛ обоих лёгких на основном этапе операции на трахее и главных бронхах при достаточной их длине позволяет поддерживать удовлетворительное состояние основных показателей газообмена и гемодинамики (РаОз до 200 мм рт.ст., РаССО2 30—32 мм рт.ст., сердечный выброс 6,5—7,0 л/мин, внутрилегочный шунт 19—22 % от МОС, систолическое давление в легочной артерии 14—18 мм рт.ст., количество общей внесосудистой жидкости в лёгких 2,5—3,0 мл/кг).
ВЧ ИВЛ неэффективна, если после пересечения дыхательных путей длина дистального отрезка трахеи или главного бронха, в который вводят вентиляционный катетер, меньше 2,5—3 см. В этих случаях в дистальный отрезок дыхательных путей мы рекомендуем вводить армированную трубку и применять систему «шунт—дыхание», как было у одного из на-
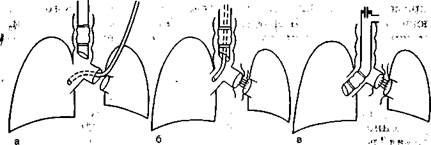
Рис. 16.5. ВЧ ИВЛ при операциях на глаэных бронхах (схема), а — резекция главного бронха; б, в — наложение швов анастомоза.
блюдавшихся нами больных, которому выполнили резекцию 11 колец и протезирование грудного отдела трахеи по поводу аденокистозного рака.
ВЧ ИВЛ имеет большие преимущества перед другими методами ИВЛ при операциях по поводу бронхоплевральных свищей, в первую очередь свищей главных бронхов, образующихся после пневмонэктомии. Проведение ВЧ ИВЛ не требует герметичности дыхательного контура, создает оптимальные условия для работы хирурга, препятствует аспирации крови.
При пластических операциях на бронхах на основном этапе операции однолегочную струйную ВЧ ИВЛ осуществляют через катетер, вводимый в просвет дыхательных путей со стороны операционного поля либо через интубационную трубку (рис. 16.5). Можно также использовать инжекционную ВЧ ИВЛ, присоединяя инжектор аппарата ВЧ ИВЛ к интубацион-ной трубке, введенной в просвет главного бронха. Надувная манжета интубационной трубки должна быть коллабирована. Однолегочную ВЧ ИВЛ проводят в течение 3—4 ч при операциях по поводу опухолей и Рубцовых стенозов бронхов и бронхиальных фистул. При этом обеспечивается высокое РаСО2, однако недостаточно удаляется углекислота и РаССО2 повышается до 50,0—75,0 мм рт. ст., значительно увеличивается венозное шунтирование (до 43—45 %) и общая внесосудистая жидкость (до 3,0—4,0 мл/кг). Тем не менее показатели центральной гемодинамики в условиях однолегочной ВЧ ИВЛ свидетельствуют о лучшем состоянии кровообращения, чем при традиционной однолегочной ИВЛ [Выжигина М.А. и др., 1995]. К такому же выводу пришли H.Koga и соавт. (1986).
Технику резекции бронхов с высокочастотной вентиляцией использовали M.McKinney (1988), N.Koga и соавт. (1986), F.Guinta (1985). Сложности возникали при резекции бифуркации трахеи с левосторонней пневмонэктомией из стернотомного доступа. Мы
применяли традиционную ИВЛ левого и ВЧ ИВЛ правого (остающегося) лёгкого. Для облегчения выполнения хирургических манипуляций левый главный бронх после его пересечения переводили из зоны операционных действий в левую сторону от аорты. В него вводили армированную интубационную трубку, соединяли её с системой «шунт—дыхание» и осуществляли традиционную ИВЛ. В правый главный бронх вводили катетер со стороны оротрахеальной интубационной трубки сквозь операционное поле и соединяли его с аппаратом ВЧ ИВЛ. Независимая вентиляция лёгких обеспечивала оптимальный газообмен и минимальное воздействие на кровообращение: увеличивался сердечный выброс, снижались давление в легочной артерии, объем венозного шунтирования, общее легочное и легочно-артериальное сопротивление, уменьшалось \ количество интерстициальной и внутриклеточной жидкости в лёгких.
У 3 из 316 больных (0,9 %), которым были произведены операции на трахее, возник напряженный пневмоторакс, связанный с применением ВЧ ИВЛ. Во всех случаях причиной напряженного пневмоторакса была обтурация просвета трахеи пальцем хирурга в процессе операции. (Следует отметить, что в этом плане целесообразно использовать ВЧ-респираторы, позволяющие мониторировать давление в дыхательных путях и прекращающие подачу газовой струи при повышении РПик)-
Таким образом, полученные нами данные свидетельствуют о высокой эффективности ВЧ ИВЛ в поддержании газообмена и об отсутствии негативных влияний на кровообращение при анестезиологическом обеспечении операций на трахее и бронхах.
Чередование методик внутривенной и ингаляционной анестезии, объемной, высокочастотной и дифференцированной независимой вентиляции лёгких, согласно виду и этапу оперативного вмешательства, позволяет обеспечить эффективный газообмен на всех этапах реконструктивно-пластических операций на трахее и бронхах и обеспечивает стабильное состояние кровообращения в большом и малом кругах. ВЧ ИВЛ предоставляет уникальные возможности для управления вентиляцией и газообменом на этапе резекции и реконструкции либо протезирования трахеи и её бифуркации и, с этой точки зрения, не имеет альтернативы.
Сформулируем основной принцип анестезиологии в легочной и трахеобронхиальной хирургии.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 1161; Нарушение авторских прав?; Мы поможем в написании вашей работы!