
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Активна кислотність визначається концентрацією водневих іонів і виражається негативним (-) логарифмом концентрації іонів водню (величиною рН). 1 страница
|
|
|
|
Стериниє провітамінами вітаміну Д. У рослинних організмах міститься ергостерин, який перетворюється у вітамін Д2, у тваринних організмах міститься дегідрохолестерин, який під впливом ультрафіолетового проміння перетворюється у вітамін Д3.
Протеїди - білки, які крім амінокислот, мають ще яку-небудь небілкову групу, котра називається простатичною. До цих білків належать фосфопротеїди, глікопро- теїди, ліпопротеїди, хромопротеїди.
Фосфопротеїди - білки, до складу яких обов'язково входить фосфорна кислота, яка зв'язана ефірним зв'язком з оксигрупою амінокислот серин і треонін. Це важливі харчові білки для молодого організму. Представниками фосфопротеїдів є такі білки, як казеїноген молока, вітелін яйця, іхтулін ікри риб.
Ліпопротеїди - складні білки, які мають залишки ліпідів. Вони розчиняються у воді і не розчиняються в органічних розчинниках. Ліпопротеїди є основою біологічних мембран рослин і тварин, які регулюють проникнення речовин з однієї клітини в іншу. Утворення ліпопротеїдів забезпечує перенесення і розчинність ліпідів у тканинах і клітинах. У вільному вигляді входять до складу крові, молока, жовтка яйця тощо.
Глікопротеїди у своєму складі мають вуглеводи (глюкозу, галактозу, манозу). Ці білки зустрічаються в усіх тканинах рослин, тварин, мікробів і вірусів. Головними представниками глікопротеїдів є муцини і мукоїди, що входять до складу хрящів, кісток, рогівки ока, травних соків.
Хромопротеїди у своєму складі, крім залишків амінокислот, мають небілкові забарвлені сполуки, які можуть належати до різних класів органічних речовин. Вони досить поширені у продуктах рослинного і тваринного походження. Наприклад, сполуки хлорофілу з білком відіграють важливу роль в засвоєнні вуглекислого газу повітря рослинами; гемоглобін (сполука білка глобіну і барвної речовини гема) відповідає за забезпечення кожної клітини тваринного організму киснем.
Нуклеопротеїди - складні білки, що мають нуклеїнові кислоти. Вони входять до складу кожної клітини, відіграють важливу біологічну роль не тільки тому, що беруть участь в утворенні структурних елементів клітин, а й тому, що виконують такі важливі функції в організмі, як передача спадкових властивостей.
Питання для самоконтролю
1. Яку роль виконують білки в організмі людини?
2. Вміст білків у продовольчих товарах та їх роль у формуванні харчової цінності продуктів.
3. Амінокислотний склад білків.
4. Дайте характеристику рівнів організації структури білкової молекули.
5. Яку роль відіграють незамінні амінокислоти в організмі людини? Що таке амінокислотний скор?
6. Чим зумовлена амфотерність білків? Яке значення має ця властивість у процесах переробки продовольчої сировини?
7. Що таке денатурація білків? Які фактори викликають денатурацію?
8. Як змінюються властивості денатурованих білків?
9. Що таке гідроліз білків і як цей процес впливає на якість харчових продуктів?
10. Дайте характеристику простих білків.
11. Дайте характеристику складних білків.
ФЕРМЕНТИ
У будь-яких живих організмах утворюються складні речовини білкової природи, які називаються ферментами і відіграють головну роль в обміні речовин та інших життєвих процесах організмів. Без ферментів організм загинув би від виснаження навіть при надмірі найпоживнішої їжі, тому що вона б не могла бути засвоєною.
Ферменти - це своєрідні роботи, пристосовані для виконання певної хімічної реакції. Якщо реакція складна, то її, подібно до автоматичної лінії, поетапно виконують декілька ферментів
Однією з особливостей тваринного організму є здатність здійснювати необхідні для життєдіяльності перетворення речовин при відносно низьких температурах. Так, наприклад, в лабораторних умовах сахароза гідролізується при тривалому нагріванні (65-67°С) із сильними концентрованими кислотами. Тим часом в організмі людини цей процес іде з великою швидкістю за короткий час при температурі близько 37°С та концентрації соляної кислоти 0,4-0,5%. Академік І. П. Павлов зазначав, що ферменти відіграють величезну роль, вони обумовлюють хімічні процеси, завдяки яким здійснюється життя, вони і є в повному розумінні збудниками життя. Ферменти діють як у клітинах, так і після виділення з клітин. Причому в клітинах вони за одних умов сприяють розпаду речовин, за інших - синтезу, поза клітинами ферменти лише розщеплюють речовини.
Але не тільки в живому організмі діють ферменти. Процеси ферментації сировини при виробництві багатьох харчових продуктів (вина, хліба, кисломолочних товарів) використовувались давно, незалежно від того, що люди довго не могли проникнути у таємниці цих процесів.
Властивості ферментів. Ферменти - це білкові сполуки, то закономірно, що вони мають всі ті властивості, які характерні для білків. Головною відмінною властивістю ферментів є здатність каталізувати хімічні реакції. На відміну від неорганічних каталізаторів ферменти строго специфічні каталізатори.
Слід розпізнавати специфічність субстрату і специфічність реакції.
Під специфічністю субстрату розуміють здатність ферменту каталізувати певні реакції в одному або декількох субстратах, які мають подібні структури.
Специфічність ферментативної реакції - найважливіша біологічна властивість ферментів. Біологічні каталізатори не тільки регулюють швидкість хімічних реакцій, а й визначають, які речовини і в якій послідовності повинні зазнати перетворення. Взаємозв'язана дія ферментів мовби організує життєві процеси і, крім того, визначає з різноманітних можливих шляхів той необхідний, а може, і єдиний шлях, по якому повинен іти процес. Специфічність ферментів може виражатись по-різному.
Більшість ферментів мають абсолютну специфічність, тобто перетворюють або один субстрат, якщо реакція мономолекулярна, або точно визначену пару субстратів, якщо реакція має бімолекулярний характер.
Більшість ферментів каталізують тільки одне перетворення даної речовини, один тип реакції. Ця властивість має особливе значення для практики, оскільки при обробці ферментами складних систем необхідно провести реакції якогось конкретного типу.
Ферменти, в разі оптичної ізомерії молекул, здатні впливати тільки на один ізомер.
Ферменти мають абсолютно фантастичну, поки що недосяжну в жодному звичайному хімічному виробництві «продуктивність праці». Доказом цього можуть служити кілька прикладів: одного грама реніну,- який іноді використовується в сироварній промисловості, достатньо для того, щоб викликати денатурацію казеїну, який міститься в 50 тоннах молока; амілаза слини проявляє каталітичну активність при розведенні 1:1 000 000.
Ферменти як білки залежно від складу молекули можуть бути однокомпонентними (складаються тільки із залишків амінокислот, як протеїни) або двокомпонентними (крім залишків амінокислот мають ще небілкові групи, як протеїди). Якщо в молекулі двокомпонентного ферменту небілкова група є органічною сполукою, то вона називається коферментом.
Принципова відмінність молекули ферменту від молекули білка в тому, що фермент, беручи участь у прискоренні хімічної реакції, діє не всією масою молекули, а тільки певною ділянкою, яка дістала назву активного центру. Більшість ферментів має один активний центр, а деякі - два і більше. Кількість активних центрів перебуває у відповідній залежності від молекулярної маси ферменту. Чим більша молекулярна маса, тим більша кількість активних центрів утворюється в молекулі ферменту.
Активний центр є динамічним утворенням з оптимальним розміщенням різноманітних функціональних груп, які зв'язують субстрат і забезпечують біокаталітичну реакцію. Активний центр визначає каталітичну активність і специфічність ферментів, він повинен забезпечити досить тісну взаємодію з молекулами субстрату.
Вважається, що активний центр розташовується не в межах якого-небудь невеликого відрізка одного поліпептидного ланцюга, а являє собою сукупність груп, розташованих на двох або кількох пептидних ланцюгах або на різних ділянках одного, але дуже закрученого пептидного ланцюга, і становить не жорстку структуру, а еластичну, яка мовби пристосовується до форми субстрату. В однокомпонентних ферментах активний центр утворюється безпосередньо амінокислотними залишками в заспіралізованому ланцюгу білкової молекули. Активною групою багатьох однокомпонентних ферментів виступають сульфгідрильні (SH) або гідроксильні (ОН) групи.
У двокомпонентних ферментах активний центр утворюється небілковою ділянкою і деякими амінокислотними залишками, які примикають до цієї ділянки, але головною частиною активного центру все ж таки є кофермент.
Швидкість і характер ферментативних реакцій залежить від таких чинників, як температура, рН середовища, окиснювально-відновний потенціал реакції, наявність активаторів (інгібіторів) специфічної або неспецифічної дії, а також від таких важливих параметрів процесу, як концентрація ферменту і концентрація субстрату.
Вплив температури на швидкість ферментативної реакції досить багатоплановий. Підвищення температури прискорює саму каталітичну реакцію, а також прискорює денатурацію (інактивацію) ферментативного білка. Також при нагріванні денатурація відбувається набагато швидше, ніж будь яке інше хімічне перетворення.
Дія всіх ферментів у значній мірі залежить від рН середовища, навіть при тих значеннях рН, коли не може бути й мови про інактивацію ферментного білка в лужному або кислому середовищі. Для кожного ферменту існує рН-оптимум активності. Іноді каталітична активність ферменту проявляється в досить вузькій зоні значень рН. Наявність оптимуму рН пояснюється тим, що ферменти, як і всі білки, мають електричний заряд і їх структура залежить саме від рН середовища.
Швидкість ферментативної реакції залежить від наявності в системі активаторів або паралізаторів ферментів. Досить велика кількість речовин, які в певній мірі порушують природну структуру ферментного білка і гальмують швидкість реакції, що каталізується ферментом. Так діють солі важких металів (міді, свинцю, ртуті та інших), формальдегід, сечовина тощо.
Дуже важливим чинником, що впливає на швидкість ферментативного процесу, є концентрація ферменту. Частіше за все існує сувора пропорціональність між концентрацією ферменту і початковою швидкістю реакції.
Класифікація ферментів. Нині відомо понад 2000 ферментів, і кількість їх постійно зростає. Відповідно до рішень Міжнародного біохімічного союзу в основу сучасної класифікації ферментів покладено типи хімічних реакцій, які вони каталізують. Згідно з цією класифікацією всі ферменти поділяються на 6 класів, кожен клас поділяється на підкласи, які, у свою чергу, поділяються на підпідкласи. Підпідкласи складаються з окремих представників. У літературі використовують тривіальну (робочу) і систематизовану номенклатуру. Згідно з тривіальною номенклатурою назва ферментів більш коротка і не завжди показує характер дії ферменту. Наприклад: пепсин, трипсин, хімозин. Систематизована назва досить точно визначає дію ферменту, складається з двох частин: перша частина відповідає назві головного субстрату, друга - характерові каталітичної реакції плюс суфікс -аза. Так, наприклад, фермент, який каталізує гідроліз пептидного зв'язку між двома залишками гліцину, називається гліцилгліцину гідролаза.
Оксидоредуктази - двокомпонентні ферменти, які каталізують окиснювально-відновні реакції, що відбуваються при диханні та бродінні як у живих організмах, так і в деяких харчових продуктах.
У цьому класі ферментів найбільший інтерес становлять підкласи дегідраз, оксидаз і оксигеназ.
Дегідрази каталізують відщеплення водню від окиснюваної речовини і переселення його до будь-якої іншої речовини, що відновлюється.
Оксидази - це ферменти, що каталізують переміщення водню від окиснюваної речовини до кисню.
Оксигенази катал;зують приєднання кисню безпосередньо до якої-небудь речовини.
Трансферази - ферменти, які каталізують реакції перенесення груп і атомів від однієї органічної речовини (донатора) до іншої (акцептора). Вони беруть участь в обміні нуклеїнових кислот, білків, вуглеводів, ліпідів. Залежно від того, яку групу переносять ферменти, вони одержують і відповідну назву: метилтрансфераза, амінотрансфераза, глюкозилтрансфераза.
Гідролази каталізують реакцію гідролізу. Більшість гідролаз - однокомпонентні ферменти, досить поширені у природі. При виробництві і зберіганні харчових продуктів найбільше значення мають три підкласи гідролаз: естерази, глікозидази, пептидази.
Естерази каталізують гідроліз ефірних зв'язків. До цього підкласу належать ліпази.
Глікозидази каталізують гідроліз глікозидних зв'язків. Сюди входять ферменти вуглеводного обміну (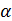 - і β-амілази, інвертаза, целюлаза та ін.).
- і β-амілази, інвертаза, целюлаза та ін.).
Пептидази каталізують гідроліз пептидних зв'язків. До цього підкласу входять ферменти білкового обміну: пепсин, трипсин, амінотрипептидаза і т. под.
Ліази - це ферменти, що каталізують негідролітичний розпад складних сполук. Більшість ліаз - двокомпонентні ферменти і мають у своєму складі фосфорні ефіри водорозчинних вітамінів. Сюди входять ферменти, які каталізують реакції декарбоксилювання (піруватдекарбоксилаза), дезамінування (аспартатаміакліаза), розпаду фруктозодифосфату у процесах аеробного і анаеробного дихання (альдолаза).
Ізомерази - ферменти, які каталізують поворотні внутрішньомолекулярні перетворення органічних речовин в їхні ізомери. Найбільше значення ферменти цього класу мають у процесах різноманітних бродінь, що відбуваються при виробництві та зберіганні багатьох харчових продуктів.
Лігази (синтетази) каталізують об'єднання простих молекул завдяки енергії розпаду аденозинтрифосфату (АТФ). Здебільшого це двокомпонентні ферменти.
Ферменти широко використовуються при виробництві харчових продуктів. Сироваріння, виробництво вина, пива, кисломолочних продуктів, хліба, чаю було б неможливим, якби не було ферментів. Більшість цих процесів була відома людині задовго до того, як виникло саме слово «фермент», тому можна говорити, що практичне використання ферментів у харчовій промисловості почалося набагато раніше, ніж наукове вивчення цих речовин. В наші дні ферментологія досягла досить високого рівня, стала активно втручатися у століттями відомі процеси, удосконалюючи їх, пристосовуючи до сучасних технологічних вимог, з метою поліпшення якості готової продукції.
Одержані новтні ферментні препарати використовуються, наприклад, при виробництві хлібобулочних виробів: поліпшуються органолептичні властивості виробів, подовжується час зберігання хліба у свіжому вигляді, зменшуються витрати цінних видів сировини (цукру, жиру). Кількість цих препаратів надзвичайно мала (2-5 г на тонну борошна).
Протеолітичні ферменти дістали широке використання у м'ясній промисловості для прискорення дозрівання м'яса. У звичайних умовах це процес досить довгий (при t 2-4°С яловичина дозріває 10-14 днів). При обробці м'яса протеолітичними ферментами час дозрівання скорочується до 1-2 діб.
Широко, використовується у м'ясній промисловості фермент глюкооксидаза, який окислює глюкозу. Це має велике практичне значення, тому що навіть невелика кількість глюкози у м'ясі прискорює його псування.
Одна з найважливіших проблем харчової промисловості - це розвиток комплексної переробки сировини і відходів. На підприємствах олійної промисловості ферменти використовуються для гідролізу речовин, що містяться в лушпинні, при цьому з 1 т лушпиння одержують 170 кг кормових дріжджів. Таке ж використання ферментів при переробці інших видів насіння та кісточок як відходів консервної промисловості.
У харчовій промисловості починають використовуватися іммобілізовані ферменти. Це, так би мовити, нерухомі, закріплені на якомусь носії ферменти. У ролі носія можуть використовуватися природні або синтетичні високомолекулярні речовини: білки і полісахариди, синтетичні полімери, кераміка, пористе скло.
Прикріплення ферментів відбувається шляхом утворення хімічних зв'язків або звичайною сорбцією на поверхні. Іммобілізовані ферменти не розчиняються у воді, іммобілізація підвищує стійкість ферментів до впливів зовнішнього середовища (нагрівання, рН середовища), їх можна відділити від продуктів реакції і використовувати багаторазово.
Велике зніачення мають ферментативні процеси при зберіганні продовольчих товарів. Знаючи спрямованість дії ферментів, можна регулювати умови зберігання, тим самим уникати процесів, які призводять до псування харчових продуктів.
Питання для самоконтролю
1. Що собою являють ферменти за хімічною природою? Яке значення вони мають для організму людини?
2. Чим ферменти відрізняються від протеїнів?
3. Чим обумовлена специфічність дії ферментів?
4. Дайте характеристику загальних властивостей ферментів.
5. Роль ферментів у процесах переробки харчових продуктів.
6. Як змінюється якість та харчова цінність продовольчих товарів під впливом ферментів при зберіганні?
7. За якими ознаками та як класифікують ферменти?
НЕБІЛКОВІ АЗОТИСТІ РЕЧОВИНИ
Небілкові азотисті речовини містяться в харчових продуктах у вигляді різноманітних органічних і неорганічних сполук. Це амінокислоти, аміди жирних кислот, пуринові азотисті луги, алкалоїди, продукти ферментативного і неферментативного потемніння, нітрати і нітрити.
Деякі з цих речовин є проміжними або кінцевими продуктами білкового обміну рослинних і тваринних організмів і мають велике біологічне значення (незамінні амінокислоти), інші беруть участь у формуванні специфічного смаку, запаху і кольору харчових продуктів (алкалоїди, продукти ферментативного і неферментативного потемніння), деякі можуть викликати тяжкі отруєння організму (нітрати, окремі алкалоїди).
Вільні амінокислоти містяться в харчових продуктах у невеликій кількості, їх вміст обумовлений або незакінченим синтезом, або, навпаки, гідролізом білкових речовин. При зберіганні продовольчих товарів кількість амінокислот збільшується.
Аміди кислот - це похідні сполуки жирних кислот (RCH2CONH2). Вони поширені і в рослинних, і в тваринних організмах, але у невеликій кількості. Деякі з них (наприклад, сечовина) мають неприємний запах.
Алкалоїди - це група фізіологічно активних сполук лужного характеру, що мають у своєму складі азот. Синтез алкалоїдів можливий тільки в рослинних організмах. Ще в давнину на Далекому Сході як снодійне використовували опій - алкалоїд, який одержували з недозрілих плодів опійного маку; як протималярійний засіб використовували кору хінного дерева, яка містить алкалоїд цинхон.
Алкалоїди - це не універсально поширені речовини, а присутні у складі тільки деяких рослин, кількість яких досить обмежена. У вільному вигляді алкалоїди у природі не зустрічаються, у рослинах вони містяться у вигляді солей звичайних органічних кислот (яблучної, лимонної, винної) і специфічних (фумарової, менонової, хемідонової).
Більшість алкалоїдів у тваринному організмі проявляє високу фізіологічну активність. У малих дозах вони використовуються як лікувальні препарати, але поряд з цим є сильними отрутами. Здебільшого алкалоїди впливають на нервову систему: у малих дозах - як збуджуючий засіб, у великих - як пригнічувальний.
У харчових продуктах зустрічаються алкалоїди різноманітної хімічної природи.
З похідних сполук пурину важливими алкалоїдами є кофеїн і теобромін чаю,кави, какао. Фізіологічна дія цих алкалоїдів на організм людини проявляється у трьох напрямках: дія на нервову систему, на м'язи, на нирки. Дія кофеїну на центральну нервову систему забезпечує загальне координоване підвищення функцій головного мозку. Кофеїн сприяє підвищенню розумової активності, посилює скорочення м'язів, підвищує витривалість і працездатність м'язів. До цієї групи алкалоїдів належить також синигрин, який входить до складу гірчиці і хрону, надаючи цим продуктам гострого, пекучого смаку.
До алкалоїдів групи піридину входять алкалоїди перцю (піперин, піпероватин) і тютюну (група нікотину).
Нікотин - сильнодіючий токсичний алкалоїд. Смертельна доза для людини 40 мг. У невеликих кількостях він діє як збудник центральної і периферичної нервової системи, викликає ущільнення кровоносних судин, а отже, і підвищення кров'яного тиску. При отруєнні нікотином настає запаморочення, нудота, виступає холодний піт. У таких випадках треба вживати продукти багаті дубильними речовинами (міцний чай, каву, а іноді жувати зерна кави). Ці речовини зв'язують нікотин, утворюючи нерозчинні сполуки.
До групи стеринових алкалоїдів входять соланіни, які зустрічаються в картоплі, томатах, баклажанах.
Соланін - це глікозид, який погано розчиняється у воді, стійкий у лугах, а при нагріванні з кислотами гідролізується. Соланін є протиплазматичною отрутою. Звичайний вміст його в картоплі до 0,01% не викликає серйозних наслідків, тому що міститься головним чином у лушпинні і з ним видаляється. Але при порушенні умов зберігання картоплі (наявність світла), а також при проростанні кількість соланіну може різко збільшитися і така картопля може стати причиною сильного отруєння.
З участю азотистих речовин у харчових продуктах може змінюватися колір. Як правило, спостерігається потемніння продуктів унаслідок неферментативних (реакція меланоїдиноутворення) або ферментативних процесів (окиснення амінокислоти тирозину з участю ферменту поліфенілоксидази) і утворення меланінів.
Нітрити - солі азотистої кислоти (NaNО2) додають в ковбасний фарш, м'ясокопченості, солонину для зберігання рожевого кольору готових продуктів. Міністерством охорони здоров'я України встановлено гранично допустиму норму нітритів у м'ясопродуктах (не більше 0,002-0,005%), тому що ці солі сприяють утворенню нітрозамінників, які мають токсичні і канцерогенні властивості.
Нітрати - це солі азотної кислоти (NaNО3). У харчові продукти головним чином потрапляють з ґрунту. Рослини здатні накопичувати значні кількості нітратів. У великих дозах ці сполуки токсичні для організму людини, а особливо для дітей, Міністерством охорони здоров'я України встановлені гранично допустимі концентрації (ГДК) нітратів у харчових продуктах. Наприклад, виноград столовий, яблука, груші, кавуни - 60 мг, огірки, перець солодкий - 200 мг, картопля - 120 мг на 1 кг продукту.
Питання для самоконтролю
1. Як впливають алкалоїди на організм людини?
2. Дайте характеристику окремим групам алкалоїдів, що містяться у продовольчих товарах.
3. Яку роль відіграють алкалоїди у формуванні споживних властивостей продовольчих товарів?
4. Яку роль відіграють нітрати і нітрити у продовольчих товарах?
РЕЧОВИНИ, ЩО ФОРМУЮТЬ БІОЛОГІЧНУ ЦІННІСТЬ ХАРЧОВИХ ПРОДУКТІВ
До складу харчових продуктів входять різноманітні речовини, які відіграють певну роль у формуванні харчової цінності продовольчих товарів. Важливим фактором, що впливає на харчову цінність продовольчих товарів, є їх біологічна цінність, яка залежить від вмісту біологічно цінних речовин: вітамінів, гормонів, імунних тіл, мінеральних елементів та ін.
Вітаміни - це органічні речовини різноманітної хімічної природи, які присутні в харчових продуктах у невеликій кількості, але є біологічно цінними речовинами і беруть активну участь у хімічних та біохімічних процесах у живих клітинах. В організмі людини вітаміни не можуть синтезуватися і повинні надходити з їжею.
Термін «вітамін», запропонований польським біохіміком К.Функом (від лат. vita - життя), у детальному перекладі означає життєво необхідний амін. У складі всіх відомих К. Функу вітамінів була аміногрупа. Але детальне вивчення структури і складу різних вітамінів показало, що багато з них не мають аміногрупи, зате майже всі вони містять гідроксильну групу. Однак термін «вітамін» зберігся за цією групою сполук і до цього часу.
Відсутність вітамінів у раціоні харчування, навіть при достатній кількості речовин енергетичного балансу, викликає глибокі порушення обміну речовин, внаслідок чого виникають хвороби, які називають авітамінозами. Нестача в їжі будь-якого вітаміну викликає хворобливий стан організму, який дістав назву гіповітамінозу. Надмірне вживання вітамінів і нагромадження їх в організмі може призвести до гіпервітамінозу.
Авітамінози та гіповітамінози можуть бути вилікувані при введенні в організм відповідних вітамінів. Але безконтрольне використання синтетичних вітамінів може призвести до гіпервітамінозу, який лікується набагато важче, ніж авітаміноз, а іноді й не піддається лікуванню.
Досить складним питанням у вітамінології є питання класифікації вітамінів. Згідно з однією з класифікацій вітаміни поділяють на дві групи залежно від розчинності: жиророзчинні (вітаміни А, Д, Е, К) і водорозчинні (вітаміни В1, В2, В3, В6, В9, ВІ2, В15, С, РР, Р, Н та ін.). На думку багатьох дослідників, така класифікація не відображає усієї багатогранності складної хімічної будови цих речовин. Характер відношення кожного вітаміну до води (жиру) можна змінити введенням у структуру молекули ліпофільних або ліпофобних груп, які не змінять рівня біологічної активності. Так, наприклад, L-аскорбінову кислоту можна перетворити в жиророзчинну сполуку шляхом етерифікації будь-якою жирною кислотою, фосфорний ефір вітаміну А не розчиняється в жирах, а розчиняється у воді. Тому більш об'єктивною й раціональною слід вважати класифікацію вітамінів, яка заснована на хімічній структурі молекули. На цій основі вітаміни можна поділити на чотири групи:
1. Вітаміни аліфатичного ряду (С, В3).
2. Вітаміни ароматичного ряду (К).
3. Вітаміни аліциклічного ряду (А, Д).
4. Вітаміни гетероциклічного ряду (Е, В 1, В2, В6, В12, РР, Н).
Крім того, вітаміни можна поділити за термостійкістю на термостабільні (Д, Е, К, В1, В2, В6, В12, РР), термолабільні (С, В5, В9), напівстабільні (А, В4).
За чутливістю до світла (особливо ультрафіолетової частини спектра) вітаміни можна поділити на стабільні (РР, В8), нестабільні або чутливі до УФ-променів (А, Д, Е, К, В2, В6, В12), і напівстабільні (В1, В3, В9, С, Н, Р).
За здатністю окиснюватися киснем повітря є вітаміни, які легко окиснюються (А, С, Е, В1, Р), і вітаміни, які важко піддаються окисненню (Д, К, РР, В15, Н, В3, В4).
Характеристика окремих вітамінів
Вітамін С (аскорбінова кислота). Цинга - хвороба, яка викликається відсутністю вітаміну С в раціоні харчування. Вона була одним з головних масових незаразливих захворювань, відомих в історії. Для цього захворювання характерні риси: кровоточивість ясен, синці на шкірі, припухлість і біль у суглобах. Вітамін С дуже нестійкий проти факторів зовнішнього середовища, при переробці і зберіганні харчових продуктів втрати вітаміну С значно більші, ніж інших вітамінів.
Завдяки тому, що аскорбінова кислота легко окиснюється, вона бере участь в окиснювально-відновних реакціях організму. Вітамін С бере участь в утворенні деяких білків сполучних та опорних тканин, тому його нестача призводить до того, що кровоносні судини стають малоеластичними і погано проникними.
Вітамін С в ролі лікувального препарату використовується не тільки при захворюванні на цингу, а й при хворобах печінки, легеневих та носових кровотечах, є профілактичним засобом проти атеросклерозів. Вітамін С легко руйнується у нейтральному і лужному середовищі.
У харчових продуктах є стабілізатори, які зберігають вітамін С при термічній обробці. Це такі речовини, як білки яйця, квасолі, рису, крохмаль (особливо перлової та вівсяної крупів).
Для тваринного організму головним джерелом вітаміну С є рослинна їжа. Велика кількість вітаміну С міститься в сухій шипшині - 1500 мг%, чорній смородині - 300, зеленій цибулі - 60, капусті - 30 мг%. Добова потреба людини - 75-100 мг вітаміну С.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 728; Нарушение авторских прав?; Мы поможем в написании вашей работы!