
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Тепловая диаграмма
|
|
|
|
Для удобства рассмотрения многих термодинамических процессов вводится понятие энтропии - приведенной теплоты.
dq = TdS, т.е. dS = — - формально энтропию можно рассматривать как
функцию, полный дифференциал которой определяется приведенным выражением.
Очевидно, что если тепло подводится (dq0), то энтропия возрастает, если отводится - то энтропия убывает. Энтропия не может быть измерена непосредственно, либо косвенным путем. Ее величину определяют в результате расчета непосредственно применяется для вычислений изменений энтропии в термодинамических процессах. Ts-диаграмма
В термодинамике для анализа работы тепловых машин весьма широко используются энтропийные диаграммы (TS, iS идр.).
Наиболее распространена Ts-диаграмма (тепловая диаграмма). В этой диаграмме площадь под кривой процесса пропорциональна количеству подведенного тепла, как это показано на рис. 2.4
*(если не видно диаграмму, там короче формула T=f(S).Внизу, где две стрелки-d S.
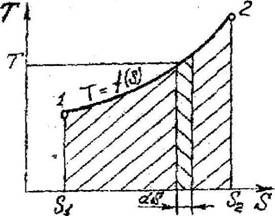
(если не видно диаграмму, там короче формула T=f(S).Внизу, где две стрелки-d S.
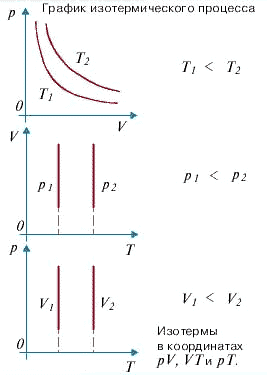
11) Изотермический процесс -это процесс, происходящий в физической системе при постоянной температуре (T = const).
При постоянной температуре dU =0, поэтому все сообщаемое системе количество теплоты расходуется на совершение работы против внешних сил.
Изотермический процесс:
dQ = dA
12) Изобарный процесс -это процесс, происходящий в физической системе при постоянном давлении (p = const). При этом изменяются объем и температура, следовательно, совершается работа dA = pdV и изменяется внутренняя энергия dU.
Изобарный процесс:
dQ = dU+pdV
При изобарном процессе dQp = CpdT, поэтому первое начало термодинамики примет вид:
CpdT = CvdT + pdV
Уравнение состояния для моля идеального газа:
pV = RT
Для изобарного процесса это уравнение примет вид
pdV = RdT
Соотношения Cp = Cv+R или Cp-Cv = R называют уравнением Майера.
13) Изохорный процесс -это процесс, происходящий в физической системе при постоянном объёме (V = const). Так как V = const, то dV =0, а следовательно, и dA = pdV = 0.
Вся теплота, сообщенная газу при изохорном процессе, идет на увеличение его внутренней энергии.
Изохорный процесс:
dQ = dU
CvdT = dU
(Cv - молярная теплоемкость газа при постоянном объеме)
14) Адиабатный процесс - это процесс, протекающий без теплообмена с окружающей средой.
Адиабатными можно считать быстро протекающие процессы. При быстром сжатии газа затрачивается работа, приводящая к увеличению внутренней энергии и повышению температуры. Тело, температура которого повышена, должно некоторое количество теплоты передать окружающей среде, но процесс теплопередачи требует некоторого времени, поэтому при быстром сжатии (или расширении) теплота не успевает распространиться из данного объема, то есть dQ = 0, и процесс можно рассматривать как адиабатный.
Адиабатный процесс (первое начало термодинамики):
dA = -dU.
15) Политропный процесс это процесс, в котором теплоемкость остается постоянной. Политропным процессом являются изохорный, изобарный, изотермический и адиабатный процессы, потому что все они имеют общую особенность - они происходят при постоянной теплоемкости.
В первых двух процессах теплоемкости соответственно равны Cv и Cp, в изотермическом процессе (dT=0) теплоемкость равна бесконечности, в адиабатном политропный процесс равна нулю. График политропного процесса показан ниже:
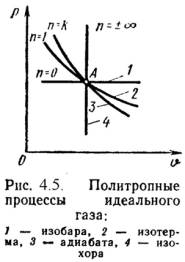
Политропа это график зависимости между параметрами состояния идеального газа при 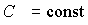 . Политропа в координатах p, V - гипербола, занимающая промежуточное положение между изотермой и адиабатой.
. Политропа в координатах p, V - гипербола, занимающая промежуточное положение между изотермой и адиабатой.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (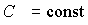 ), можно вывести уравнение политропы:
), можно вывести уравнение политропы:
 - уравнение политропы,
- уравнение политропы,
где 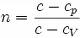 - показатель политропы.
- показатель политропы.
16)(не уверен в билете, одна фигня в интернете) Многоступенчатые поршневые компрессоры широко применяются для автоматизации промышленных предприятий, в автомобилестроении, используются для заправки баллонов для систем пожаротушения, аварийно-спасательных служб и баллонов дыхательных агрегатов.
Поршневые компрессоры невероятно востребованы, поскольку это наиболее дешевое средство производства и переработки сжатого воздуха. К тому же при профессиональном подходе, многоступенчатые поршневые компрессоры не только высокоэкономичные, но и удобные в обслуживании.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 6527; Нарушение авторских прав?; Мы поможем в написании вашей работы!