
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Многоэлектронный атом. Спектроскопические обозначения. Электронная конфигурация
|
|
|
|
Многоэлектронный атом. Оператор Гамильтона многоэлектронного атома. Приближение невзаимодействующих частиц. Качественно объяснение структуры периодической таблицы химических элементов.
Полная энергия электронной оболочки многоэлектронного атома состоит из нескольких слагаемых, и отображающий её многоэлектронный гамильтониан атома также включает в себя несколько слагаемых. Это следующие операторы:
Принципы заполнения атомно-орбитальных уровней и построение основных электронных конфигураций: 1) водородоподобие (одноэлектронное приближение в атоме), 2) минимум энергии, 3) принцип Паули, 4) максимальный суммарный спин (1-е правило Хунда). Примеры основных электронных конфигураций легких атомов. Возбужденные атомные конфигурации.
Схема приближенного представления энергии электронного отталкивания в виде энергии экранирования ядра.
Все двухэлектронные слагаемые отталкивания в гамильтониане оболочки атома образуют двумерный косоугольный массив. Их следует просуммировать и приближённо представить суммой, слагаемые которой распределены по отдельным частицам. В таком приближении многоэлектронный гамильтониан примет аддитивный вид. На этом основании можно ввести приближение независимых электронов-"одноэлектронное" приближение.
В результате дальнейших работ (после анализа решения уравнения Шредингера для атома водорода) выяснилось, что эти понятия – квантовые числа и их физический смысл – применимы и для всех других атомов Периодической системы элементов.
Вследствие этого была выработана схема строения многоэлектронных атомов, к рассмотрению которой мы и приступаем.
Атомные орбитали в этой схеме обозначаются двумя символами. Первый – число – соответствует значению главного квантового числа n. Второй – латинская буква – соответствует значению орбитального квантового числа l. Например, 1s-орбиталь. Это орбиталь, у которой n=1, а l=0. Ещё пример: 5f-орбиталь. У неё n=5, а l=3.
Все орбитали с одинаковым значением n образуют энергетический уровень. Общее число орбиталей на энергетическом уровне равно n2. Орбитали энергетического уровня с разными значениями l образуют энергетические подуровни этого энергетического уровня.
В результате сравнения предсказаний теории с экспериментальными данными (прежде всего – спектроскопическими) были определены энергии атомных орбиталей для различных элементов. Оказалось, что для большинства из них ряд, выстроенный по возрастанию энергии, имеет один и тот же вид:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d
Эта последовательность, которая называется А-последовательностью (от немецкого Aufbau – конструкция, структура), может быть построена по правилу Клечковского Правило гласит: энергия атомных орбиталей возрастает с ростом суммы n+l. При равном значении суммы энергия больше у орбитали с большим значением n. Подробности и исключения см. учебник [1], с.93.
Как мы видели из свойств магнитного квантового числа m, количество орбиталей с данным l равно 2l+1, т.е. в этом ряду все s орбитали (l=0) – единственны, все p-орбитали (l=1) существуют в трех разновидностях, все d-орбитали (l=2) – в пяти, а все f-орбитали (l=3) – в семи.
Исходя из вышеизложенного, схема орбиталей многоэлектронного атома приобретает вид:
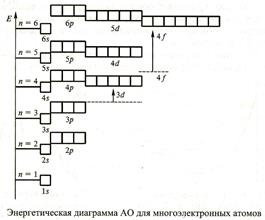
Подобные схемы носят название электронографических диаграмм.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1071; Нарушение авторских прав?; Мы поможем в написании вашей работы!