
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные термодинамические потенциалы
|
|
|
|
Химический потенциал.
Хим. потенциал опред. по ф-ле:
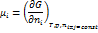
где G – свободная энергия Гиббса
Для однокомпонентного раствора: µ = G
Для многокомпонентного:
µ·N = G
Хим. пот-л характер-ет приращение
термодинам. потен-ла при изменении кол-ва данного вещ-ва и постоянстве естествен. переменных и кол-в осталь. вещ-в.
Химический потенциал зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае — смеси идеаль-х газов — µi зависит лишь от конц-ции рассмат-го компонента и от тем-ры:
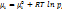
где pi — парц-е давление компонента i в смеси, R — газовая постоянная, 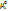 — значение
— значение  при pi = 1 атм.
при pi = 1 атм.
Термод. пот-лы обладают след. св-вами:
1)их изменение при заданных усл-х равно работе, произ-й сис-мой
2)состояние термод. равновесия, кот-я принимает миним-е значение
3)при обратимых процессах диф-лы любого пот-ла яв-ся полным диф-лом.
Выбор пот-лов зависит от условий, в кот-х нах-ся система:
1)если сис-ма изол-на от внешн. воздействия, то U = const, S = const. В кач-ве термод. пот-ла в этом случае применяется внутр. энергия
dU = TdS – pdV (1)
U = TS - pV
2) для систем, изолир. термически (S= const), но не механически (p=const) потенциалом может быть энтальпия:
H = U+pV
dH = TdS + VdP (2)
3) Если система нах-ся в условиях пост. объема и тем-ры пот-лом яв-ся свободная энергия Гельмгольца
F = U – TS
dF = -SdT – pdV (3)
4) Если T = const, p = const, то пот-лом яв-ся свободная энергия Гиббса:
G = U + pV – TS
dG = Vdp – SdT
Потенциалы могут быть получены один из другого при помощи преобр-ния Лежандра: к диф-лу прибавляют или вычитают диф-л произ-ния обобщ. силы на сопряженную координату:
dU+d(pV) = TdS – pdV + pdV + Vdp = =TdS + Vdp = dH
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 323; Нарушение авторских прав?; Мы поможем в написании вашей работы!