
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формальная кинетика химических реакций
|
|
|
|
Статистический расчет химического равновесия.
Рассмотрим реакцию A + 2 B = D.
Условие равновесия - ZA – 2 ZB +Z D = 0
или, учитывая формулу G = А + p υ = - RT ln (Z e/ NA) + RT = - RT ln (Z / NA)

Здесь Z содержит объем в качестве множителя. Поэтому предположим Zi = PiVi,
где Pi носит название функции распределения.
Исключив Z из уравнения и учитывая, что концентрация ci равна NA/Vi, получим
cD / cAc 2 B = PD / PAP 2 B
Таким образом:
Kc = PD / PAP 2 B. (1)
При расчете функций распределения для разных молекул используются разные уровни отсчета энергии. Для учета этого обстоятельства, в соответствии с уравнением Z ′ = Z eε0/ kT , необходимо умножить правую часть уравнения (1) на е-Δ E / RT , где Δ E - разность уровней отсчета.
Поскольку за нулевой уровень при расчете сумм состояний принимается энергия молекул при абсолютном нуле, то Δ E = - Q 0,
где Q 0 - теплота реакции при абсолютном нуле.
Таким образом, вместо уравнения (1) получим
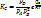
Пусть имеется реакция aA+bB=gG+hH, тогда скорость химической реакции. Скоростью химической реакции ω называется скорость изменения концентрации какого-либо из участвующих в ней веществ. В гетерогенных реакциях, протекающих на поверхности пористых твердых тел, скорость реакции относят к единице массы или объема твердой фазы, а в случае жидких или твердых фаз при известной поверхности - к единице поверхности раздела. Скорость может выражаться одной из следующих производных. 
Между изменениями концентрации реагирующих веществ существует соотношения определяемые стехиометрическими коэффициентами a,b,g, и h. по скорости изменения концентрации только одного из реагирующих веществ можно определять скорость изменения концентрации остальных реагентов. Скорость химической реакции есть функция концентраций реагирующих веществ и температуры, т.е. ω = f (с, Т).
Существуют два основных метода измерения скорости химических реакций: динамический и статический. Схема динамического метода  .
.
Смесь реагирующих веществ при низкой температуре подается в реакционную зону Р, где поддерживается достаточно высокая для протекания реакции постоянная температура Т. Необходимо, чтобы смесь из реакционной зоны выходила максимально быстро и вновь попадала в зону с низкой температурой, где реакция практически прекращается, а смесь "закаливается". Производя анализ смеси до поступления в зону Р и после закалки и зная время пребывания смеси в реакционной зоне, определяют скорость реакции. В статических методах проводятся измерения концентраций реагирующих веществ без непрерывного введения и выведения смеси из реакционной зоны. Часто скорость реакции определяют путем измерений каких-либо физических свойств, зависящих от концентрации. скорость прямой реакции A + 2 B → AB 2 определяется выражением
ω = -d cA /dτ = kcAcB (1) где k - константа скорости реакции, которая также называется удельной скоростью реакции.
Уравнения, такого типа называются кинетическими. Порядком реакции называется сумма показателей степеней, в которых входят концентрации в кинетическое уравнение. В действительности же реакции третьего порядка встречаются очень редко, а реакции более высоких порядков вообще не наблюдаются. Уравнения (1) были сформулированы на основе упрощенных представлений о том, что для реакции необходимы одновременные столкновения молекул реагентов в соответствии со стехиометрическим уравнением и применимы лишь к элементарным актам. Часто реакции бывают нулевого, первого и второго порядка. Наряду с понятием порядка реакции введено понятие молекулярное, т.е. числа частиц, действительно принимающих участие в элементарном акте реакции (в мономолекулярной - одна частица, в бимолекулярной - две). Таким образом, понятие порядка реакции эмпирическое, а молекулярности теоретическое.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!