
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория переходного состояния при химической реакции
|
|
|
|
Теория активных столкнов-й Аррениуса.
Одной из первых теорий, объясняющей механизм химических реакций была теория активных столкновений. Эта теория считала, что химическая реакция является результатом столкновения взаимодействующих частиц. Шведский физико-химик Аррениус предположил, что взаимодействуют лишь частицы, обладающие избыточной энергией. Аррениус вывел закономерность, по которой скорость химической реакции зависит от температуры в виде следующего уравнения: W = A.exp[-E/(RT)], где А - множитель, отражающий количество соударений реагентов, которое приводит к химической реакции между ними. В реакцию вступают не все частицы системы, а лишь те, которые обладают некоторой избыточной энергией, по сравнению со средней энергией остальных частиц. В противном случае все реакции протекали бы со взрывом. Аррениус назвал эту избыточную энергию - энергией активации. Максвелл и Больцман открыли одну из важнейших закономерностей молекулярной физики и физики вообще, связав энергию молекулы с температурой: NE= N0.exp[-E/(RT)], где NE - доля молекул с энергией E, N0 - общее количество молекул в изучаемой системе, T - температура, R - универсальная газовая постоянная.
Закон Максвелла-Больцмана показывает распределение молекул по энергиям их движения в идеальном газе. Он был выведен теоретически и подтвержден большим количеством экспериментов. Таким образом, экспериментально найденная зависимость скорости реакции от температуры была подтверждена законом распределения молекул по энергиям.
Основа теории активных столкновений:
Для того чтобы произошла химическая реакция, молекулы реагентов должны:
1) столкнуться; 2) обладать достаточной энергией - энергией активации;
3) иметь благоприятную ориентацию для скорейшего взаимодействия друг с другом.
Энергии активации по ТАС должна по своему значению быть близкой к энергии связи в молекуле, которая разрушается в ходе химической реакции.
Теория активных столкновений установила связь между скоростью химической реакции, размером молекул, энергией их поступательного движения, частотой столкновений, но не объясняет, почему энергия молекулы, необходимая для вступления в реакцию (энергия активации), обычно намного меньше энергии химической связи, которую нужно разорвать, для того чтобы реакция произошла.
Всякая хим.рек. или процесс, протек. со временем(диффузия) нах.-ся в непрерывном измен. Конфигурация ядер с начальной1 превращается в конечную. 
В работах Эйрингом и Полингом теория переходного состояния принимается, что исходные в-ва нах-ся в равновесном сост. С активным комплексом. перех. сост. можно рассматривать как обыкновенную молекулу, хар. опред-ыми ТД св-вам, за исключ. того, что кроме обычн. 3 ст. свободы имеет 4 ст. св., связанное с движением вдоль пути реакции. Молекула может иметь 3N степеней свойств.
Рассмотрим в общем виде реакцию через переходный комплекс. А+В=х++=>C+++D. Перех. сост. нах. в равнов. с исходными в-вами, поэтому скорость реак. опред. скорость перехода комплекса через потенциальный барьер. С++ - концентрация перехода.
Скорость рек. опред. числом расходов перех. сост. в ед. скорости или ед.времени:  (1) Τ м.б. выражена через среднюю скорость движения перех. сост. вдоль пути реакции:
(1) Τ м.б. выражена через среднюю скорость движения перех. сост. вдоль пути реакции: 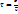 (2)
(2)
Скорость одномерного дв. м.б опред: 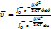 , где
, где
μ-приведенная масса, отвечающая относительному движению отображающей точки по пути реакции.  (3)
(3)  (4)
(4)
Т.к. переходное сост. нах. в с равновес. с исходными вещ.-вами, то для нахождения ее концентрации можно исп.закон действия масс:  (5), где К*-константа равновесия.
(5), где К*-константа равновесия.
Т.к. концентрация переходного состояния пропорциональности пути  .
. 
 (6). Подставим (4) в(1):
(6). Подставим (4) в(1):  (7). Сопоставим (7) с уравн. для больших реакций, получаем конст. скорости, связанную с константой равновесия:
(7). Сопоставим (7) с уравн. для больших реакций, получаем конст. скорости, связанную с константой равновесия: 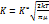 (8). Теория переходного состояния устанавливает связь между кинетич. и ТД величинами.
(8). Теория переходного состояния устанавливает связь между кинетич. и ТД величинами.  м.б. выражена с пом. Функции распределения
м.б. выражена с пом. Функции распределения  .Распределение переходного сост.можно выразить как произвед. α функций распределения.
.Распределение переходного сост.можно выразить как произвед. α функций распределения. 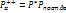
 , где h-постоянная планка.
, где h-постоянная планка.
В переходное состояние точка движется в одном направлении.
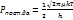 ;
;  ;
; 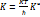 .
.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 388; Нарушение авторских прав?; Мы поможем в написании вашей работы!