
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость концентрации реагентов от времени для реакции первого порядка
|
|
|
|
1) В реакциях 1-го порядка в закрытых системах типа А —> В скорость прямо пропорциональна концентрации:

При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [А]о = а, текущая концентрация [А] = а – x(t), где x(t) - концентрация прореагировавшего вещества А. В этих обозначениях кинетическое уравнение для реакции первого порядка и его решение имеют вид: 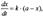
 Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции: 
Время, за которое распадается половина вещества А, называют периодом полураспада 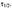 Он определяется уравнением
Он определяется уравнением  и равен
и равен 
2) В реакциях первого порядка в открытой системе решение кинетического уравнения  (1) зависит от числа продуктов реакции. Пусть в реакции А —> В +... из одной молекулы А образуется
(1) зависит от числа продуктов реакции. Пусть в реакции А —> В +... из одной молекулы А образуется 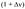 молекул продуктов, а степень превращения А составляет х, тогда количество А и общее количество газов равны, соответственно:
молекул продуктов, а степень превращения А составляет х, тогда количество А и общее количество газов равны, соответственно: 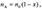 (2)
(2) 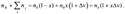
Концентрацию исходного вещества выразим через парциальное
давление, которое найдем по закону Дальтона: 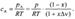 (3)
(3)
Подставляя (1) и (2) в общее кинетическое уравнение
(3), получаем для реакции первого порядка дифференциальное уравнение, описывающее зависимость степени превращения  от координаты
от координаты  вдоль потока в реакторе:
вдоль потока в реакторе: 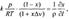 где
где 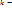 константа скорости,
константа скорости,  - площадь сечения реактора.
- площадь сечения реактора.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 661; Нарушение авторских прав?; Мы поможем в написании вашей работы!