
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на скорость химических реакций
|
|
|
|
Зависимость концентрации реагентов от времени для реакции второго порядка.
В реакциях типа А + В —> D +... скорость
прямо пропорциональна произведению концентраций:
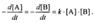 Начальные концентрации веществ: [А]о = а, [В]о = b; текущие концентрации: [А] = а - x(t), [В] = b - x(t).
Начальные концентрации веществ: [А]о = а, [В]о = b; текущие концентрации: [А] = а - x(t), [В] = b - x(t).
При решении этого уравнения различают два случая.
1) Одинаковые начальные концентрации веществ А и В: а = b. Кинетическое уравнение имеет вид: 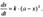
Решение этого уравнения записывают в различных формах:
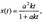
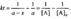
Период полураспада веществ А и В одинаков и равен: 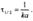
2) Начальные концентрации веществ А и В различны: 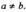 Кинетическое уравнение имеет вид:
Кинетическое уравнение имеет вид: 
Решение этого уравнения можно записать следующим образом: 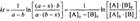
Периоды полураспада веществ А и В различны: 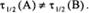
Скорость большинства реакций увеличивается с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения - правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа заключается в том, что при нагревании на
10 °С скорость большинства химических реакций увеличивается в 2 - 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:  где у - температурный коэффициент скорости
где у - температурный коэффициент скорости  .
.
Правило Вант-Гоффа довольно грубо описывает экспериментальные данные и применимо только в очень ограниченном интервале температур. Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости: 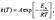 где R-универсальная газовая постоянная.
где R-универсальная газовая постоянная.
Это уравнение содержит два параметра, характеризующих химическую реакцию: А - предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; ЕА - энергия активации, которую можно охарактеризовать как некоторую пороговую энергию, характеризующую высоту энергетического барьера на пути реакции. Энергия активации также не зависит от температуры. Для большинства реакций в растворе энергия активации
|
|
|
составляет 50-100 кДж/моль.
Экспоненциальный множитель в уравнении Аррениуса можно интерпретировать, как долю молекул, энергия которых превышает ЕА при температуре Т. В самом деле, если рассмотреть больцмановскую функцию распределения по энергии: 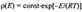 , то доля молекул с Е > ЕА дается выражением:
, то доля молекул с Е > ЕА дается выражением: 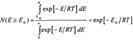 .
.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!