
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомогенный катализ в растворах
|
|
|
|
Катализ.
Катализ - изменение скорости химической реакции в присутствии катализаторов. Катализ называют положительным, если скорость реакции увеличива-ется, и отрицательным, если скорость уменьшается. При гомогенном катализе реагенты и катализатор находятся в одной фазе, при гетерогенном катализе — в разных фазах.
Катализатор — вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Катализатор, замедляющий реакцию, называют ингибитором. Биологические катализаторы белковой природы называют ферментами.
Механизм действия катализаторов состоит в том, что они образуют промежуточные соединения с исходными веществами и тем самым изменяют путь реакции, причем новый путь характеризуется другой высотой энергетического барьера, т.е. энергия активации изменяется по сравнению с некатализируемой реакцией. В случае «+» катализа она уменьшается, а отрицательного - увеличивается.
Так как изменение ТД функций в химических реакциях определяется только состоянием реагентов и продуктов и не зависит от промежуточных стадий (закон Гесса), то катализатор не может повлиять ни на тепловой эффект реакции, ни на энергию Гиббса, ни на константу равновесия (в случае обратимой реакции). В последнем случае катализатор изменяет лишь время достижения равновесного состояния, но не его ТД характеристики.
Простейшая схема гомогенного катализа включает обратимое образование промежуточного комплекса катализатора (К.) с одним из реагирующих веществ и превращение этого комплекса в продукты реакции с
высвобождением катализатора:
А + К  АК,
АК,
АК + В  C+D+K.
C+D+K.
Сопоставим в общем случае скорости в газе и в жидкости используя теорию переходного состояния.  Будем полагать, что газ подчиняется идеальному закону. Для неидеальных систем константа равновесия активации для бимолекулярных уравнений:
Будем полагать, что газ подчиняется идеальному закону. Для неидеальных систем константа равновесия активации для бимолекулярных уравнений: 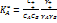 . Отсюда
. Отсюда 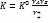 . При обычных давлениях в газовых реакциях коэффициент активности близок к 1, в р-рах – отличается. Поэтому, К0 можно рассматривать как константу скорости в газовой среде, а К – в р-ре.
. При обычных давлениях в газовых реакциях коэффициент активности близок к 1, в р-рах – отличается. Поэтому, К0 можно рассматривать как константу скорости в газовой среде, а К – в р-ре. 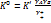 . Влияние взаимодействия с растворителем может заключаться в степени энергии реагирующих частиц по величине энергии сольватации. Если, например, реагирующие молекулы сольватированы, а переходные состояния не сольватированы, то ЕА увеличивается, а скорость – уменьшается, если сольватированы переходные состояния, а исходные нет, то реакция ускоряется. Влияние электронов на скорость реакции в растворах проявляется в первичном и вторичном соляных эффектах: 1 – изменяются коэффициенты активации реагирующих веществ, 2 – фактическое изменение концентрации ионов реагентов в результате добавления реагентов.
. Влияние взаимодействия с растворителем может заключаться в степени энергии реагирующих частиц по величине энергии сольватации. Если, например, реагирующие молекулы сольватированы, а переходные состояния не сольватированы, то ЕА увеличивается, а скорость – уменьшается, если сольватированы переходные состояния, а исходные нет, то реакция ускоряется. Влияние электронов на скорость реакции в растворах проявляется в первичном и вторичном соляных эффектах: 1 – изменяются коэффициенты активации реагирующих веществ, 2 – фактическое изменение концентрации ионов реагентов в результате добавления реагентов.
Многие гомогенные реакции катализируются кислотами или основаниями. Влияние кислот и оснований на скорость реакции в водных растворах привела к заключению, что Н+ и ОН- различаются каталитическими свойствами. Кислоты и основания могут обмениваться протонами в реакциях: кислота – донор, основание – акцептор. Подобные реакции, заключающиеся в переходе протона, которые могут переходить и вне водных растворах. Равновесие в таких реакциях наз-ся кислотно-основным. К + О  К+ + О-. Катализ кислотой обусловлен переходом протона от К к R(исх.в-во) с образованием неустойчивого соед-ия типа RH, которое, распадаясь, дает конечный продукт, или регенерирует кислоту. К + О
К+ + О-. Катализ кислотой обусловлен переходом протона от К к R(исх.в-во) с образованием неустойчивого соед-ия типа RH, которое, распадаясь, дает конечный продукт, или регенерирует кислоту. К + О 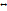 RH+ + О-;
RH+ + О-;
RH+ + О- 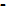 К + X; RH + О-
К + X; RH + О- 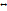 К + R-; R- + K
К + R-; R- + K 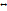 X + О-. такие каталитические реакции можно рассматривать как двустадийные реакции. R
X + О-. такие каталитические реакции можно рассматривать как двустадийные реакции. R 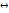 RH+
RH+  X, где К1,K2,K3 – константы скорости соответствующих реакций.
X, где К1,K2,K3 – константы скорости соответствующих реакций.
Если скорость распада промежуточного состояния с образованием продукта Х > обратного превращения R, то между R и RH+ не может установиться равновесие. В этом случае сумма скоростей реакции определиться скоростью первой стадии. Поскольку концентрация кислоты остается постоянной, то должна иметь место реакция первого порядка. Если же скорость превращения комплекса RH+ мала, то будет устанавливаться равновесие между R и RH+ и скорость процесса в целом определяется произведением равновесной концентрации этого комплекса на К3.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 971; Нарушение авторских прав?; Мы поможем в написании вашей работы!