
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение сульфата железа (ii) в лекарственных формах
|
|
|
|
Расчет
ОПРЕДЕЛЕНИЕ ПЕРЕКИСИ ВОДОРОДА В ЛЕКАРСТВЕННОЙ ФОРМЕ
СТАНДАРТИЗАЦИЯ РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ ПО ОКСАЛАТУ НАТРИЯ
МЕТОД ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ
ЛАБОРАТОРНАЯ РАБОТА
Ход анализа. Бюретку заполняют раствором КМnО4 (доводя раствором титранта до нуля по верхнему мениску).
В колбу для титрования пипеткой вносят аликвотные части раствора оксалата натрия Na2C2O4 (10, 20 мл), подкисляют 10-20 мл 2н. раствора серной кислоты (кислоту отмеряют цилиндром), нагревают эту смесь до 70-80°С (без кипячения раствора). Нагретый раствор титруют перманганатом до бледно-розовой окраски, не исчезающей в течение 30 сек. Вначале обесцвечивание идет очень медленно, по мере накопления ионов Мn2+ реакция идет быстрее. Измерение объема окрашенного титранта ведут по верхнему мениску. Титрование повторяют несколько раз, до получения воспроизводимых результатов, отличающиеся не более чем на 0,1 мл.
Записывают все полученные объемы, берут среднее из воспроизводимых результатов. Рассчитывают молярную концентрацию эквивалента:
Расчет С(1/5КМnО4)= (СH·V)Na2C2O4 / V(КМnО4)
ЛАБОРАТОРНАЯ РАБОТА
Ход анализа. В колбу для титрования пипеткой вносят аликвотную часть 10 мл (предварительно разбавленного в 20 раз) раствора перекиси водорода лекарственной формы, подкисляют 10 мл 2н раствора серной кислоты (кислоту отмеряют цилиндром) и содержимое колбы титруют (без нагревания) рабочим раствором перманганата калия до появления неисчезающего, розового окрашивания. Титрование повторяют еще 1-2 раза.
m(Н2О2) =  ,
,
ω(Н2О2) =  , где
, где
СН (KMnO4) – нормальность раствора перманганата;
V (KMnO4) - объем перманганата калия, пошедшего на титрование, мл;
VK-объем мерной колбы;
Va- аликвотная часть перекиси водорода, мл;
Мэ (Н2О2) – молярная масса эквивалента перекиси водорода;
V(Н2О2)- исходный объем перекиси водорода лекарственной формы, взятый для разбавления;
ρ(Н2О2)- плотность раствора перекиси водорода (можно принять равной 1гр/мл).
ЛАБОРАТОРНАЯ РАБОТА
Определение железа (II) хроматометрическим методом основано на прямом титровании ионов железа (II) стандартным раствором бихромата в сернокислой или солянокислой среде в присутствии фосфорной кислоты:
6Fe2+ + Cr2O72- + 14H+ ® 6Fe3+ + 2Cr3+ + 7H2O
Фосфорную кислоту прибавляют для того, чтобы связать в комплекс образущиеся ионы железа (III), что благоприятствует титрованию Fe2+:
6Fe3+ + 18HPO42- ® 6[Fe(HPO4)3]3-
Методика определения. Одну таблетку препарата взвешивают на аналитических весах (без растирания) и переносят в мерную колбу на 100 мл, добавляют 40 мл 2 н раствора серной или хлористоводородной кислоты и около 20 мл концентрированной фосфорной кислоты. Таблетку осторожно разминают в колбе стеклянной палочкой и перемешивают. После полного растворения таблетки, объем в колбе доводят до метки дистиллированной водой и перемешивают. Аликвотную часть раствора (20 мл) переносят при помощи пипетки в коническую колбу, добавляют несколько капель раствора дифениламина (1 %-ный раствор в конц. H2SO4), и титруют при перемешивании 0,05 н раствором дихромата калия до появления синей окраски.
Расчет: где: w(FeSO4), % =  , где
, где
CH – концентрация дихромата калия, н
V – объем дихромата, пошедшего на титрование, мл
MЭ(FeSO4) – эквивалентная масса сульфата железа (II)
Va – объем раствора соли железа, взятого для титрования, мл
m –навеска таблетки, г
Vk – объем мерной колбы, мл.
КОНТРОЛЬНАЯ ЗАДАЧА
Определение меди
Йодометрическое определение меди основано на реакциях:
2Сu2++5I-=2СuI↓+I3- -
I3 - + 2S2O32- = ЗI-+ S4O62- E Сu2+/СuI=0,86 В
Для протекания первой реакции необходимо создать в растворе слабокислую среду для предотвращения гидролиза Сu2+ (и тем самым для повышения потенциала системы Сu2+/СuI) и брать большой избыток йодида (для понижения потенциала системы I3-/3I- и растворение йода).
Выполнение работы: Заполнить бюретку раствором тиосульфата натрия. Контрольную задачу в мерной колбе доводят до метки дистиллированной водой, тщательно перемешивают. Отбирают пипеткой 10 мл анализируемой раствора и переносят в коническую колбу для титрования, добавляют цилиндром 5 мл 2Н раствора серной кислоты, 10 мл 5% раствора КI и титруют тиосульфатом натрия до желтой окраски суспензии. После этого добавляют 1 - 2 мл 1%-ного раствора крахмала и продолжают титрование до исчезновения синей окраски и образования осадка цвета слоновой кости (бледно-розовый цвет). В процессе титрования раствор с осадком необходимо тщательно перемешивать.
Обработка результатов:
т(Си2+)= 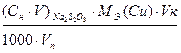
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 662; Нарушение авторских прав?; Мы поможем в написании вашей работы!