
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 3. Влияние катализатора на скорость химической реакции
|
|
|
|
Опыт 2. Зависимость скорости химической реакции от температуры.
В одну пробирку внесите 3 мл 0,1 М раствора тиосульфата натрия Na2S2O3, а в другую пробирку – 3 мл 2 н серной кислоты H2SO4 и измерьте время от момента добавления кислоты до появления первых признаков помутнения раствора.
Второй и третий опыты проведите аналогично первому, но при температуре соответственно на 10 и 200 выше комнатной. Для этого пробирки с растворами выдержите в стакане с водой соответствующей температуры 5 минут, затем смешайте. Температуру в стакане контролируйте с помощью термометра. Отметьте время от начала опыта до момента помутнения. Результаты опыта занесите в таблицу 2.2.
Рассчитайте скорость реакции по формулам, приведенным в первом опыте.
Рассчитайте средний температурный коэффициент реакции:
γср. = (γ1 + γ2)/2, если γ1 =  , а γ2 =
, а γ2 = 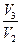 .
.
Сделайте вывод о зависимости скорости реакции от температуры.
Внесите в пробирку 10 капель пероксида водорода и наблюдайте процесс разложения пероксида водорода (медленное выделение пузырьков газа):
2Н2О2 → 2Н2О + О2
Добавьте к раствору пероксида водорода несколько кристалликов диоксида марганца. К отверстию поднесите тлеющую лучинку. Какую роль играет диоксид марганца в этой реакции?
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №2
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: изучение зависимости скорости химической реакции от концентрации реагирующих веществ, температуры и катализатора.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Гомогенная реакция
__________________________________________________________________
Гетерогенная реакция
__________________________________________________________________
Скоростью химической реакции называется
______________________________________________________________________________________________________________________________________________________________________________________________________
Скорость реакции зависит от следующих факторов:
1._________________________________________________________________
2._________________________________________________________________
3._________________________________________________________________4.___________________________________________________________________________________________________________________________________
Зависимость скорости химической реакции от концентрации (или давления) реагирующих веществ выражается
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние температуры на скорость реакции описывается
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Энергия активации реакции
______________________________________________________________________________________________________________________________________________________________________________________________________измеряется_________________________________________________________
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ.
Исследуемая реакция:_______________________________________________
Закон действующих масс для этой реакции:
__________________________________________________________________
Таблица 2.1
| № пробирки | Объем, мл | Относительная концентрация | Время t начала помутнения, с | Относительная скорость | |||
| Na2S2O3 | H2O | H2SO4 | Vтеор. | Vпракт. | |||
Вывод:
____________________________________________________________________________________________________________________________________
Опыт 2. Зависимость скорости химической реакции от температуры.
Правило Вант-Гоффа:
____________________________________________________________________________________________________________________________________
Зависимость скорости реакции от температуры:
__________________________________________________________________
Уравнение Аррениуса:
__________________________________________________________________
Таблица 2.2
| № пробирки | Объем, мл | Температура опыта, 0С | Время t начала помутнения раствора, с | Относительная скорость | |
| Na2S2O3 | H2SO | ||||
| V1 = 1 | |||||
| V2 | |||||
| V3 |
Расчет температурного коэффициента:
γср. = (γ1 + γ2)/2, если γ1 =  , γ2 =
, γ2 = 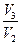 .
.
__________________________________________________________________
γ1 =; γ2 =; γср. =.
Вывод:
______________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Влияние катализатора на скорость химической реакции.
Катализатором называют
______________________________________________________________________________________________________________________________________________________________________________________________________
Катализ – это
____________________________________________________________________________________________________________________________________
Исследуемая реакция:_______________________________________________
Наблюдаемые явления:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Вывод:
____________________________________________________________________________________________________________________________________
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1529; Нарушение авторских прав?; Мы поможем в написании вашей работы!