
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Прямое титрование
|
|
|
|
Контрольные вопросы
МЕТОД КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Контрольные вопросы
ОБЩИЕ СВЕДЕНИЯ О ТИТРИМЕТРИЧЕСКОМ МЕТОДЕ АНАЛИЗА
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Промывание осадков промывной жидкостью содержащей разноименные с осадком ионы
75. Сколько граммов йодата кальция растворится при промывании осадка 50 мл воды, содержащей 0,3 г хлорида аммония?
76. Сколько граммов серебра растворится, если осадок бромата серебра промывать 100 мл воды, содержащей 0,2 г нитрата калия?
77.Сколько граммов сульфат-иона перейдет в раствор, если осадок сульфата стронция промывать водой, 100 мл которой содержат 0,3 г хлорида калия?
Перед тем, как ответить на предложенные вопросы, ознакомьтесь с соответствующим теоретическим материалом по литературе [1, гл.5; 2, гл.1. 4; 3, т.2, гл.1, 4, m. l, гл.9; 5, т.2, разд. 9.2], ориентируясь на программу.
78. Перечислите основные требования к реакциям в титриметрии.
79. Перечислите способы выражения концентрации растворов.
80. Что такое эквивалент, фактор эквивалентности, молярная масса эквивалента?
81. Приведите классификацию методов титриметрии по типу химической реакции и по способу титрования.
82. Дайте определение первичного и вторичного стандарта.
83. Перечислите требования, предъявляемые к первичным стандартам (иначе - установочным, исходным, стандартным веществам).
84. Что такое стандартные растворы? Какие способы их приготовления Вы знаете?
85. Что такое фиксанал?
86. Как рассчитывают результаты титрования?
87. Что такое титр по определяемому веществу?
88. Что такое кривая титрования?
89. Что такое точка эквивалентности (стехиометричности), конечная точка титрования?
90. Что такое скачок титрования?
91. Что такое титр?
92. Что такое молярная концентрация, молярная концентрация эквивалентов?
93. В чем заключается сущность различных способов титрования (прямое, обратное, по заместителю)?
94. Как определяют молярные массы эквивалентов веществ?
95. Поясните на конкретном примере принцип титриметрического метода анализа.
96. Какие типы реакций используют в титриметрическом методе анализа?
Рассмотрите теоретические основы метода по учебникам [I, гл.5, разд. 5.5; 2, гл. 7; 3, т.2, гл.2; 4, m. l, гл. 10; 5, т.2, разд. 9.2], затем можно приступить к ответам на поставленные вопросы.
97. Укажите установочные вещества и стандартные растворы метода кислотно-основного титрования.
98. Какие вещества называются кислотно-основными индикаторами? Какие соединения используются в качестве кислотно-основных индикаторов?
99. Как объясняется изменение окраски индикатора с точки зрения теории индикаторов?
100. Назовите основные характеристики кислотно-основных индикаторов.
101. Что называют показателем титрования и интервалом перехода индикатора?
102. Какая связь существует между константой диссоциации и интервалом перехода индикатора?
103. Как подбирают индикаторы при титровании по методу нейтрализации?
104. Каковы принцип и цель построения кривых титрования метода нейтрализации?
105. Какие факторы влияют на величину скачка и положение точки эквивалентности на кривой титрования?
106. При каком условии можно провести ступенчатое титрование многоосновных кислот?
107-109. Как проводится определение методом нейтрализации:
107. солей аммония?
108. щелочей?
109. кислот?
110-112. Как проводится раздельное определение при совместном присутствии в растворе:
110. NaOH и Nа2СO3?
111. карбонатов и гидрокарбонатов?
112. смеси кислот?
2.2.2 Вычисления при приготовлении рабочих растворов
Необходимые для расчета формулы и примеры решения приведены в [1, гл.5, разд. 5.3.; 2, гл. 4,3, т.2, гл.1, 4, m. l, гл.9; 5, т.2, разд. 9.2; 7. с.8, задачи 1-9].
113. Из 2,500 г Na2CO3 приготовлено 500 мл раствора. Рассчитать для этого раствора: а) нормальность, б) молярность, в) титр и г) титр пo HCI.
114. Какова нормальность и молярность раствора H2SO4, титр которого равен 0,005122?
115. Какова нормальность раствора Ва(ОН)г с Т'Ва(ОН)2/СНзСООН = 0,01210?
116. а) Каков ТHCl/NH3 для 0,1125 н. раствора HCI? б) Вычислить для 0,1122 н. раствора HCI молярность, титр по HCI и титр по СаО.
117.Сколько граммов щелочи, содержащей 92% NaOH и 8% индифферентных примесей, следует взять для приготовления 1 л раствора с титром 0,00500?
б) Сколько граммов такой щелочи требуется для приготовления 700 мл 0,15 н. раствора?
в) Сколько граммов ее требуется для приготовления 1,5 л раствора с ТNaOH/CaO= 0,00300?
118. Сколько миллилитров 10,0%-ного раствора и Na2CO3 плотностью 1,105 требуется для приготовления: а) 1 л раствора с Т = 0,00500; б) 1 л раствора с Т Na2СОз/СаО =0,00300?
119. До какого объема следует разбавить 1 л 0,2000 н. раствора HCl, чтобы получился раствор с титром по СаО 0,005000?
120. Сколько миллилитров дымящей соляной кислоты плотностью 1,19, содержащей 38,32.% (вес.) HCl, следует разбавить до 1500 мл, чтобы получить 0,2000 н. раствор?
121. 1 л раствора щелочи был приготовлен из 42 г едкого натра, содержащего кроме NaOH 2% Na2CO3 и 6% H2O. Какова нормальность полученного раствора (если считать, что Na2CO3 титруется кислотой до Н2СОз)?
122. Сколько миллилитров воды надо прибавить к 1,2 л 0,2120 н. раствора HCl для того, чтобы получился 0,2000 н. раствор?
123. Сколько миллилитров 2,0 н. раствора HCI следует добавить к 1,1 л 0,1880 н. раствора HCI для того, чтобы получился 0,2000 н. раствор?
124. Сколько миллилитров 2н. раствора H2S04 надо прибавить к 1 л раствораH2S04 с титром по СаО×0,004500, чтобы получился раствор с титром по СаО0,005000?
125. Сколько миллилитров 23,13% раствора КОН плотностью 1,22 надо прибавить к 1 л 0,984 н. раствора КОН, для того чтобы получился 1,000 н. раствор?
126. Какой нормальности должен быть раствор NaOH, чтобы при анализе навески доломита в 0,5 г, когда М определяют титрованием раствором NaOH, каждый миллилитр лого раствора соответствовал 1% Mg?
Вычисления при определении концентрации рабочих растворов
127. Какова нормальность раствора HCl, если на титрование 0,1946 г химически чистой Na2CO3 идет 20,45ли этого раствора?
128. Какова молярность раствора H2SO4 если на титрование 0,4519 г буры (Na2B407×10H2O) идет 16,43 млэтого pаствора?
129. Рассчитать титр раствора HCI, если на титрование 0,2147г Na2CO3 идет 22,26 мл этого раствора.
130. Рассчитать Т HCl/Na2CO3 раствора соляной кислоты, если при титровании на 0,1231 г Na2CO3 идет 20,45 мл этого раствора.
131. Рассчитать Т HCl/СаО, если при титровании на 0,1040 г Na2CO3 идет 25,14 ли этого раствора.
132. Рассчитать ТNaOH/P2O5 для раствора едкого натра, применяемого при определении свободного Р205 в суперфосфате (титрованием НзР04 до
NaH 2P04), если на 0,1005 г H2C204 идет 24,42 мл этого раствора NaOH.
133. На 1,025 г H2C20×2H20 идет 24,10 м л раствора NaОH.
Рассчитать: а) титр этого раствора, б) его титр по H2C204 в) его нормальность.
134. При титровании на 20 мл раствора НС1 с Т = 0,003512 иэрасходовано 21,12 мл раствора NaOH.
Вычислить а ) ТNaOH/HCI;б) ТNaOH и в) ТNaOH/H2SO4
135. На 20 мл 0,2135 н. раствора НС1 при титровании идет 15,35 мл раствора NaOH. Определить нормальность раствора NaOH.
136. Из 6,227 г буры приготовлено 250 мл раствора. 25,00 мл этого раствора реагируют с 24,17 мл раствора НС1.Рассчитать нормальность растворов: а) буры и б) НС1.
137. Рассчитать нормальность растворов: а) НС1 и б) NаОН, если на титрование 0,8714 г буры идет 21,12 мл раствора НС1. Объемное соотношение 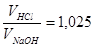
138. 20 мл 0,2215 н. раствора НС1 требуют для нейтрализации 21,40 мл раствора Ва(ОН)2, а 25 мл уксусной кислоты нейтрализуются 22,55 мл того же раствора. Определить нормальность уксусной кислоты.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 2324; Нарушение авторских прав?; Мы поможем в написании вашей работы!