
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Химическая кинетика и равновесие
|
|
|
|
Химическая кинетика и равновесие
Химические реакции протекают с разными скоростями. Некоторые протекают практически мгновенно, другие – медленно. Взаимодействие может как замедляться, так и ускоряться. Необратимые реакции протекают до полного израсходования одного из реагентов. Многие реакции протекают обратимо.
Скорость химической реакции определяется многими факторами. Необходимо учитывать природу реагирующих веществ, условия взаимодействия и в какой системе – гомогенной или гетерогенной – протекает процесс. В первом случае под скоростью подразумевается изменение количества вещества в единице объёма (т.е. изменение молярной концентрации) за единицу времени, во втором – изменение количества вещества, отнесённое к единице поверхности раздела фаз в единицу времени:
 или
или 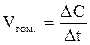 ;
; 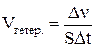 .
.
Зависимость скорости химической реакции от природы реагирующих веществ и их концентрации определяется законом действующих масс:скорость химической реакции в каждый момент времени пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, соответствующих их стехиометрическим коэффициентам.
Для системы аА + вВ → сС + dD он имеет вид:
V=k[A]a[в]в,
где k – константа скорости, определяемая природой реагирующих веществ; [A] и [B] – концентрации реагирующих веществ.
Константа скорости численно равна скорости данной реакции при единичных концентрациях всех реагирующих компонентов.
Зависимость скорости от температуры определяется правилом Вант-Гоффа, установленным для гомогенных химических реакций, согласно которому скорость и константа скорости увеличиваются в 2÷4 раза при повышении температуры на каждые 10 оС. Математическое выражение имеет вид:
 .
.
Температурный коэффициент γ изменяется в пределах от 2 до 4.
Регулировать скорость можно и введением в систему катализаторов или ингибиторов.
Для обратимой реакции при равенстве скоростей прямой и обратимой реакции наступает химическое равновесие, выражение константы для которого имеет вид:
 .
.
Направление смещения равновесия подчиняется принципу Ле-Шателье: если на систему, находящуюся в равновесии, оказано внешнее воздействие, то равновесие сместится в сторону той реакции, которая уменьшит оказанное воздействие. Следует отметить, что введение катализатора не смещает равновесие, так как увеличивает скорости прямой и обратной реакций в одинаковое число раз.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!