
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Растворы. Способы выражения концентрации растворов
|
|
|
|
Свойства растворов
Растворы. Способы выражения концентрации растворов.
Система, в которой одно или несколько веществ (дисперсная фаза) распределено в другом (дисперсионная среда), называют дисперсной. Растворы – это гомогенные (однофазные) системы, состоящие из двух и более компонентов и продуктов их взаимодействия. Истинные растворы образуют системы с размерами частей менее 1 нм.
По агрегатному состоянию растворы бывают жидкие, твёрдые и газообразные. Примером первых могут быть растворы солей, кислот и оснований в воде, примером вторых – сплав никеля и меди или сплав золота и серебра, примером третьих – смесь газов.
Существуют различные способы выражения концентраций растворов. Наиболее применимые из них следующие.
Массовая доля (%) характеризует массу растворённого вещества, которая содержится в 100 г раствора:
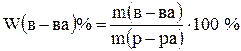 .
.
Молярная концентрация показывает число молей вещества в 1 л раствора:
 .
.
Нормальная (эквивалентная) концентрация соответствует числу эквивалентов растворённого вещества в 1 л раствора:
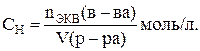
Моляльная концентрация (моляльность) оценивает количество вещества в 1 кг растворителя:
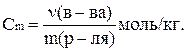
Мольная доля – отношение числа молей данного вещества к общему числу молей всех веществ, содержащихся в растворе:
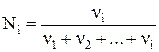 .
.
Растворимость вещества характеризуется концентрацией его насыщенного при данных условиях раствора.
Для разбавленных растворов неэлектролитов справедлив ряд законов.
1. Осмотическое давление (Pосм) равно:
Pосм= СмRT, где R – универсальная газовая постоянная.
2. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества:
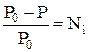 .
.
Повышение температуры кипения и понижения температуры замерзания раствора в сравнении с чистым растворителем пропорциональны моляльной концентрации:
∆tкип.= ECm;
∆tзам.= KCm,
где E – эббулиоскопическая, а K – криоскопическая константа раствори-теля.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 564; Нарушение авторских прав?; Мы поможем в написании вашей работы!