
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика решения типовых заданий
|
|
|
|
Задание 1. Определить степень окисления хрома в дихромате калия K2Cr2O7.
Решение:
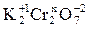
Обозначим искомую величину через x. Тогда, учитывая, что сумма степеней окисления всех атомов в молекуле равна 0 (степень окисления калия как щелочного металла равна +1, а кислорода – 2), можно записать:
2· (+1) + 2 (x) + 7(-2) = 0; x = +6.
Задание 2.
Расставьте коэффициенты в схеме реакции взаимодействия сероводорода с перманганатом калия в кислой среде на основе метода электронного баланса.
Решение:
1. Запишем схему и расставим степени окисления элементов:
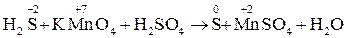 .
.
2. Составляем полуреакции окисления и восстановления и суммируем процессы:
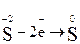
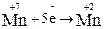
| 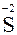 – восстановитель, окисляется – восстановитель, окисляется
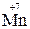 – окислитель, восстанавливается – окислитель, восстанавливается
| ||
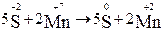
| |||
Расставляем коэффициенты при окислителе и восстановителе, а затем при других веществах в следующем порядке: металл→неметалл→водород→ сверка по кислороду. Окончательное уравнение реакции имеет вид:
5H2S + 2 KMnO4 + 3 H2SO4 →5 S0 + 2 MnSO4 + K2SO4 + 8H2O.
Задание 3. Расставьте коэффициенты в схеме реакции взаимодействия бихромата калия с сульфатом железа (II) в кислой среде на основе метода электронно-ионного баланса (метода полуреакций).
Решение:
K2Cr2O7 + H2SO4 + FeSO4→ Cr2(SO4)3 + Н2О + Fe(SO4)3 + К2SO4.
В методе полуреакций используются реальные молекулы или ионы, претерпевшие изменения:
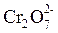 + 14Н+ + 6ē → 2 Cr3+ + 7Н2О + 14Н+ + 6ē → 2 Cr3+ + 7Н2О
| восстановление | |
| 2Fe2+ - 2ē → 2Fe3+ | окисление |
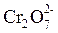 + 14Н+ + 6Fe2+ → 2 Cr3+ + 7Н2О + 6Fe3+
+ 14Н+ + 6Fe2+ → 2 Cr3+ + 7Н2О + 6Fe3+
Окончательное уравнение:
K2Cr2O7 + 7H2SO4 + 6FeSO4→ Cr2(SO4)3 + 7 Н2О + 3Fe2(SO4)3 + + К2 SO4
Задания к самостоятельной работе
Методом электронного или электронно-ионного баланса расставьте коэффициенты в уравнениях реакций, укажите окислитель и восстановитель, тип окислительно-восстановительной реакции:
61. Fe(NO3)2 + MnO2 + HNO3 → Fe(NO3)3 + Mn(NO3)2 + H2O
S + KOH → K2S + K2SO3 + H2O
62. Pb(NO3)2 → PbO + NO2 + O2
HNO3 + Cu → Cu(NO3)2 + NO2 + H2O
63. Cl2 + Br2 + KOH → KCl + KBrO3 + H2O
Cl2 + KOH → KCl + KClO3
64. H2O2 + HJO3 → J2 + O2 + H2O
Br2 + NaOH → NaBr + NaBrO + H2O
65. SO2 + HNO3 + H2O → H2SO4 + NO
NH4NO2 → N2 + H2O
66. Na2S2O3 + Br2 + NaOH → NaBr + Na2SO4 + H2O
NaNO3 → NaNO2 + O2
67. NaJ + KMnO4 + KOH → J2 + K2MnO4 + NaOH
Cu(NO3)2 → CuO + NO2 + O2
68. HJ + H2SO4 → J2 + H2S + H2O
HNO2 → HNO3 + NO + H2O
69. HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
KClO3 → KCl + O2
70. SnCl2 + K2Cr2O7 + H2SO4 → Sn(SO4)2 + SnCl4 + Cr2(SO4)3+
+ K2SO4 + H2O
Na2SO3 → Na2S + Na2SO4
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 720; Нарушение авторских прав?; Мы поможем в написании вашей работы!