
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Гальванические элементы, аккумуляторы
|
|
|
|
Гальванические элементы, аккумуляторы
Электродные потенциалы.
В электрохимических процессах также происходит изменение степени окисления веществ. Но в отличие от окислительно-восстановительных реакций процессы восстановления и окисления пространственно разделены. Для протекания электрохимического процесса необходима электрохимическая цепь, основными компонентами которой являются электроды и электролит. Приведём основные понятия, используемые в электрохимии.
Электрод – проводник 1-го рода, находящийся в контакте с проводником 2-го рода (например, металл в растворе электролита). Внешняя цепь электрохимической системы – металлический проводник, соединяющий между собой электроды.
Проводник 1-го рода – это проводник, имеющий электронную проводимость (например, металл).
Проводник 2-го рода – проводник, имеющий ионную проводимость (например, раствор или расплав электролита).
Анод – электрод, на котором происходит процесс окисления.
Катод – электрод, на котором происходит процесс восстановления.
Электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником.
При погружении металла в воду или водный раствор поверхностные атом-ионы металла взаимодействуют с молекулами воды, ориентированными у поверхности электрода. В результате этого гидратированные ионы металла переходят в раствор, и металл заряжается отрицательно, а раст- вор – положительно:
Me + mH2O → Me(H2O) 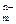 + nē.
+ nē.
Или без учёта гидратационной воды:
Me → Men+ + nē.
Катионы металла из раствора притягиваются к отрицательно заряженной поверхности, и на границе металл-раствор возникает двойной электрический слой (ДЭС). Образующаяся разность потенциалов называется электродным потенциалом Е (или φ). Наряду с переходом катионов в растворе происходит и обратный процесс:
Men+ + nē → Me.
При некотором значении электродного потенциала скорости окисления металла и восстановления его катионов выравниваются и устанавливается равновесие:
Me ⇄ Men+ + nē.
Потенциал в таких условиях называют равновесным. Абсолютную величину электродного потенциала отдельного электрода измерить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения. В качестве последних для водных сред зачастую используют хлорсеребряный или водородный электроды.
Зависимость электродного потенциала от температуры и концентрации (активностей) веществ, участвующих в электродных процессах, выражает уравнение Нернста:
Е = Е0 + 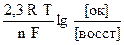 ,
,
где Е0 – стандартный электродный потенциал, т.е. потенциал данного электрода при концентрациях (активностях) всех веществ, участвующих в процессе, равных единице (значения Е0 являются табличными);
R – газовая постоянная (R=8,31 Дж/моль∙К);
Т – абсолютная температура;
F – число Фарадея (96500 кл/моль);
n – число электронов, участвующих в электронном процессе;
[ок] – произведение концентраций (активностей), веществ, участвующих в полуреакции в окисленной форме;
[восст] – произведение концентраций (активностей), веществ, участвующих в полуреакции в восстановленной форме.
При подстановке констант и значении T = 298 K уравнение Нернста принимает вид:
Е = Е0 +  .
.
Потенциал металлического электрода, погружённого в раствор собственной соли, используется наиболее часто.
Me⇄Men++nē.
Учтя, что концентрация (активность) металла в ходе реакции практически не меняется, уравнение Нернста примет вид:
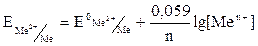 .
.
Гальваническими элементами называют устройства, в которых энергия химической реакции преобразуется в электрическую.
Основу работы любого гальванического элемента составляют окислительно-восстановительные процессы, причём реакции окисления и восстановления, протекающие на электродах, пространственно разделены. Тот электрод, на котором происходит процесс окисления, называется анодом, восстановления – катодом. Значение электродного потенциала катода (ЕК) для работающего гальванического элемента выше, чем у анода (ЕА). Каждый из электродов помещён в своё электродное пространство, содержащее ионный проводник. Движение ионов из одного электродного пространства в другое возможно за счёт наличия пор в перегородке или солевого мостика, при этом непосредственного перемешивания ионных проводников не происходит.
Электродвижущая сила (ЭДС) элемента определяется разностью потенциалов катода и анода: ЭДС = ЕК – ЕА.
Концентрации твёрдых тел и воды (для водных растворов) считают величинами постоянными. Поэтому для электрода:
 + 8H+ + 5ē ⇄ Mn2+ + 4H2O
+ 8H+ + 5ē ⇄ Mn2+ + 4H2O
 ,
,
а для электрода
Сu2+ + 2ē ⇄ Cu0
 .
.
Одними из наиболее простых гальванических элементов являются устройства из двух металлических электродов, помещённых в растворы своих солей. Таким является, например, прибор из пластин никеля в 1 М растворе NiSO4 и серебра в 0,1 М растворе AgNO3.
 ,
,
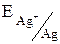 =
=  +
+ 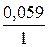 lg 10–1 = 0,799 – 0,059 = 0,74 (в).
lg 10–1 = 0,799 – 0,059 = 0,74 (в).
Так как 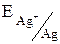 ›
›  , то серебро является катодом, а никель – анодом.
, то серебро является катодом, а никель – анодом.
| А (–): Ni – 2ē → Ni2+ К (+): Ag+ + ē → Ag0 | |
| Ni + 2Ag+ → Ni2+ + 2Ag |
Электроны при замыкании внешней цепи движутся от никеля к серебру. Схема данного гальванического элемента имеет следующий вид:
А (–) Ni│NiSO4││AgNO3│Ag (+) K.
Гальванический элемент может работать, если он составлен из одинаковых электродов, погружённых в растворы одного и того же электролита, но с разной концентрацией (концентрационный гальванический элемент). Для них значение ЭДС можно рассчитать по формуле:
ЭДС =  lg
lg  , а схема имеет вид:
, а схема имеет вид:
А (–) металл│электролит (С1) ││электролит (С2)│металл (+) K.
С1 ‹ С2.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!