
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Окислительно-восстановительные реакции
|
|
|
|
Окислительно-восстановительные реакции
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называют окислительно-восста-новительными (ОВР).
Степень окисления – это условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит только из ионов.
При определении степени окисления нужно помнить:
– степень окисления атома в простом веществе равна 0;
– степень окисления атома водорода во всех соединениях, кроме гидридов металлов, равна +1 (в гидридах металлов степень окисления атома водорода равна -1);
– степень окисления кислорода, кроме пероксидов и F2O, равна –2 (в пероксидах -1, а в F2O равна+2);
– степень окисления атомов элементов I, II, III групп главных подгрупп периодической системы равна +1, +2, +3 соответственно;
– сумма степеней окисления всех атомов в молекуле равна 0;
– сумма степеней окисления всех атомов в ионе равна заряду иона.
Окислениемназывают процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается
Al – 3e-® Al3+ H2 – 2e- ® 2H+ Fe2+ - e-® Fe3+.
Восстановлением называют процесс присоединения электронов атомом, молекулой, ионом. Степень окисления при этом понижается
S +2e- ® S 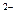 Cl2 + 2e-® 2Cl
Cl2 + 2e-® 2Cl  Fe3+ + e- ® Fe2+.
Fe3+ + e- ® Fe2+.
Атомы, молекулы или ионы, отдающие электроны, называют восстановителями. Окислителями же называются атомы, молекулы или ионы, принимающие электроны.
Вещества, содержащие атом элемента в низшей степени окисления, являются типичными восстановителями (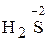 ,
, 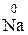 ,
,  H3); в высшей – типичными окислителями (
H3); в высшей – типичными окислителями (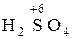 ,
, 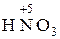 ).
).
В случае промежуточной степени окисления атома вещество проявляет окислительно-восстановительную двойственность (H2 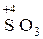 , H
, H 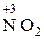 и т.п.).
и т.п.).
Для составления уравнений окислительно-восстановительных реакций используют два метода: электронного баланса и электронно-ионный (метод полуреакций).
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. Число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем.
Метод полуреакций (электронно-ионного баланса) учитывает реальное состояние веществ в растворе. При составлении уравнений методом полуреакций необходимо соблюдать ряд условий. Начинать, как и в случае метода электронного баланса, следует с составления схемы процесса. Для этого в ионном виде записывают окислитель, восстановитель и продукты их взаимодействия. Сильные электролиты записываются в виде ионов, а слабые – в виде молекул.
При составлении уравнений полуреакций следует исходить из следующего. Связывание избыточного кислорода производится в кислой среде ионами H+ с образованием молекул воды, а в нейтральной и щелочной средах – молекулами воды с образованием ионов ОН  . Недостаток кислорода восполняется в кислой и нейтральной средах молекулами воды с образованием катионов водорода, а в щелочной – гидроксид-ионами с выделением воды.
. Недостаток кислорода восполняется в кислой и нейтральной средах молекулами воды с образованием катионов водорода, а в щелочной – гидроксид-ионами с выделением воды.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 444; Нарушение авторских прав?; Мы поможем в написании вашей работы!