
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Электролиз. Коррозия металлов
|
|
|
|
Электролиз. Коррозия металлов
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из электродов и раствора или расплава электролита. При электролизе происходит превращение электрической энергии в химическую.
Наиболее простым случаем является электролиз расплавов с инертным (нерастворимым) анодом. Суть процесса при этом заключается в окислительно-восстановительных превращениях ионов, образующихся при диссоциации электролита.
Пример 1. Электролиз расплава NaCl.
NaCl ⇄ Na+ + Cl–;
| A (+): 2Cl– – 2ē → Cl2 K (–): Na+ + ē → Na | |
2Cl– + 2Na+ 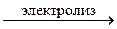 Cl2 + 2Na;
2NaCl Cl2 + 2Na;
2NaCl 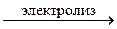 Cl2 + 2Na. Cl2 + 2Na.
|
Пример 2. Электролиз расплава KOH.
KOH ⇄ K+ + OH–;
| A (+): 4OH– – 4ē → O2 + 2H2O K (–): K+ + ē → K | |
4OH– + 4K+ 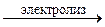 O2 + 2H2O + 4К;
4KOH O2 + 2H2O + 4К;
4KOH 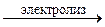 O2 + 2H2O + 4К. O2 + 2H2O + 4К.
|
При электролизе водных растворов необходимо учитывать в первую очередь возможность протекания процессов окисления и восстановления воды, а также явление перенапряжения (изменение потенциала в ходе электрохимической реакции). Из различных возможных процессов на аноде наиболее вероятен тот, потенциал окисления которого минимален, а на катоде – потенциал восстановления которого максимален.
Пример 3. Электролиз раствора CuSO4 с угольным (нерастворимым) анодом.
CuSO4 ⇄ Сu2+ +  .
.
Можно предположить следующие процессы окисления:
а) 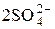 – 2ē → S2O
– 2ē → S2O 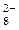
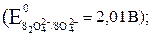
б) 2Н2О – 4ē → О2 + 4Н+ 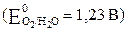 .
.
Так как 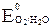 значительно меньше
значительно меньше 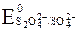 , то на аноде наиболее вероятен процесс окисления воды.
, то на аноде наиболее вероятен процесс окисления воды.
Теоретически возможные процессы восстановления на катоде:
а) Cu2+ + 2ē → Cu0 (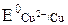 = 0,34 B);
= 0,34 B);
б) 2Н2О + 2ē → Н2 + 2ОН– (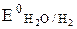 = -0,41 В).
= -0,41 В).
Так как 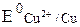 значительно больше
значительно больше 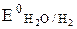 , то практически на катоде протекает восстановление ионов меди. Таким образом, реально протекающие процессы на электродах имеют вид:
, то практически на катоде протекает восстановление ионов меди. Таким образом, реально протекающие процессы на электродах имеют вид:
| А (+): 2Н2О – 4ē → О2 + 4Н+ К (–): Cu2+ + 2ē → Cu | |
2H2O + 2Сu2+  O2 + 4H+ + 2Cu. O2 + 4H+ + 2Cu.
|
С учётом имеющихся в растворе сульфат-ионов перейдём от сокращённого ионного уравнения к полному ионному, а затем к молекулярному:
2Н2О + 2Сu2+ + 
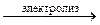 О2 + 4H+ +
О2 + 4H+ + 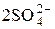 + 2Сu2+;
+ 2Сu2+;
2Н2О + 2СuSO4 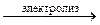 О2 + 2H2SO4 + 2Cu.
О2 + 2H2SO4 + 2Cu.
Итак, на аноде выделяется газообразный кислород, в прианодном пространстве накапливается раствор серной кислоты (вторичный продукт электролиза), а на катоде осаждается медь.
Для качественного предсказания результатов электролиза можно исходить из следующего:
– при электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы этих солей;
– при электролизе кислородсодержащих кислот и их солей, HF и фторидов на аноде происходит окисление молекул воды или ионов OH– с выделением кислорода;
– на катоде будет восстанавливаться металл, если он в ряду напряжений находится от олова и далее;
– на катоде будет происходить восстановление молекул воды, если металл в ряду напряжений стоит до титана (алюминия) включительно;
– если металл находится в средней части ряда напряжений (от Al до Sn), то возможно как восстановление катиона металла, так и восстановление молекул воды.
Пример 4. Электролиз раствора Pb(NO3)2.
Pb(NO3)2 ⇄ Pb2+ + 2NO 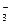 .
.
Так как NO 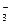 является кислородсодержащим анионом, то анодным процессом является окисление воды. Свинец в ряду напряжений находится за оловом, значит катодным процессом будет восстановление катиона Рb2+.
является кислородсодержащим анионом, то анодным процессом является окисление воды. Свинец в ряду напряжений находится за оловом, значит катодным процессом будет восстановление катиона Рb2+.
| А (+): 2Н2О – 4ē → О2 + 4Н+ K(+): Pb2+ + 2ē ® Pb0 |
2H2O + 2Pb2+ 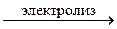 O2 +4H+ + 2Pb0;
O2 +4H+ + 2Pb0;
2H2O +2Pb2+ +4 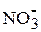
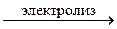 O2 + 4H+ + 4
O2 + 4H+ + 4 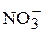 + 2Pb0;
+ 2Pb0;
2 H2O + 2Pb(NO3)2 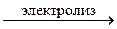 O2 + 4 HNO3 + 2Pb.
O2 + 4 HNO3 + 2Pb.
Продукты электролиза – металлический свинец и газообразный кислород. В прианодном пространстве накапливается раствор азотной кислоты.
Пример 5. Электролиз раствора NiCl2.
NiCl2 ⇄ Ni2+ + 2Cl  .
.
Некислородсодержащийся хлорид-ион окисляется на аноде. Так как никель находится в средней части ряда напряжений, то в зависимости от условий электролиза возможно как восстановление ионов Ni2+, так и молекул воды. Эти процессы могут протекать и параллельно.
А(+): 2Cl  - 2ē = Cl2;
- 2ē = Cl2;
K(-): a) Ni2+ + 2ē = Ni0;
б) 2Н2О + 2ē = Н2 + 2Н2О.
В таких случаях суммарное уравнение не составляется.
Однако не во всех случаях электродные потенциалы окисления материала анода значительно выше 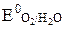 , т.е. являются нерастворимыми (из графита, платиновых металлов, золота, специальных сортов нержавеющего железа). Электролиз с использованием растворимых анодов (медь, цинк, кадмий, никель и др.) является наиболее сложным.
, т.е. являются нерастворимыми (из графита, платиновых металлов, золота, специальных сортов нержавеющего железа). Электролиз с использованием растворимых анодов (медь, цинк, кадмий, никель и др.) является наиболее сложным.
Пример 6. Электролиз раствора CuSO4 с медным анодом
| А (+): Cu - 2ē = Cu2+ K (–): Cu2+ + 2ē = Cu0 |
Cu + Cu2+ → Cu2+ + Cu0
Масса вещества (m), выделяющаяся на электродах, пропорциональна количеству электричества, прошедшего через раствор электролита (закон Фарадея):
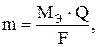
где МЭ – молярная масса эквивалента вещества, г/моль;
Q – количество электричества, кулон (Q = J(a) ∙ tc);
F – число Фарадея (96500 Кл/моль).
Самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического воздействия окружающей среды называется коррозией.
В зависимости от характера внешней среды по механизму протекания коррозия может быть химической или электрохимической.
Химическая коррозия развивается в отсутствие электролитов, т.е. характерна для сред, которые не проводят электрический ток. По условиям протекания различают газовую коррозию и коррозию в жидких агрессивных неэлектролитах. Коррозионные процессы при этом заключаются в окислительно-восстановительных реакциях, при которых электроны непосредственно переходят от металла к окислителю окружающей среды, например:
2Zn0 + 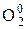 = 2
= 2 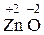 ;
;
2Fe0 + 3 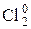 = 2
= 2 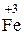
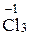 .
.
Электрохимическая коррозия развивается в средах, имеющих ионную проводимость (в растворах электролитов, атмосфере влажного газа, почве). Электрохимическая коррозия имеет много аналогий с работой гальванического элемента: окисление восстановителя (анодное окисление металла), восстановление окислителя (катодное восстановление веществ из окружающей среды), движение ионов, переход электронов от анодных участков к катодным. Отличием является отсутствие внешней цепи. Роль анода выполняет более активный металл из нескольких, участвующих в контакте или входящих в состав сплава. Катодом является менее активный металл или различные включения – графит, цементит (Fe3C), шлак, ржавчина и т.д. В последних случаях образуется множество микрогальванических элементов. В общем случае электродные процессы при коррозии могут отражаться следующими уравнениями:
Анодные процессы: Me – nē → Меn+.
Катодные процессы: а) 2H2O + O2 + 4ē = 4OH– (во влажной атмосфере); б) 2H2O + 2ē = H2 + 2OH– (в отсутствие кислорода); в) 2H+ + 2ē = H2 (в кислой среде).
Скорость коррозии возрастает с увеличением температуры, концентрации окислителей и веществ, препятствующих образованию пассивирующей плёнки (Cl–, CN–, NH3), разности потенциалов катодных и анодных участков.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!