
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика решения типовых заданий. Задание 1.Как изменятся скорости прямой и обратной реакции 2SO2(г) + O2(г) ⇄ 2SO3(г), если объём газовой смеси уменьшить в три раза?
|
|
|
|
Задание 1. Как изменятся скорости прямой и обратной реакции 2SO2(г) + O2(г) ⇄ 2SO3(г), если объём газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Напишите выражения для констант равновесия.
Решение: обозначим [SO2] = a, [O2] = b, [SO3] = c – концентрации исходных и конечных продуктов до изменения объёма. Согласно закону действующих масс до изменения объёма Vпр. = k ∙a2 ∙ b; Vобр. = k ∙ c2. При уменьшении объёма газовой смеси в 3 раза концентрация каждого из веществ увеличится тоже в 3 раза, поэтому:
 ;
;
 ,
,
отсюда
 ;
;
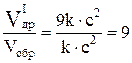 .
.
Следовательно, равновесие сместится в сторону образования SO3, так как скорость прямой реакции возрастёт в 27 раз, а скорость обратной – в 9 раз.
Ответить на вопрос о направлении смещения химического равновесия можно и на основе принципа Ле-Шателье. В левой части уравнения имеется 3 объёма газообразных веществ, а в правой – 2. Поэтому равновесие сместится в сторону прямой реакции, которая протекает с уменьшением объёма газа, а значит, и давления.
Выражение константы равновесия имеет вид:
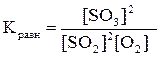 .
.
Задание 2. Определить, в какую сторону сместится равновесие в системе CO(г) + 2H2(г) ⇄ CH3OH(г) +113,13кДж, если: а) увеличить давление; б) понизить температуру; в) увеличить концентрацию H2.
Решение:
Согласно принципу Ле-Шателье:
1) при увеличении давления равновесие сместится в сторону прямой реакции, которая протекает с уменьшением числа газообразных молекул (в левой части уравнения 3 объёма газообразных веществ, а в правой – 1);
2) так как прямая реакция является экзотермической, то понижение температуры вызовет смещение равновесия в её сторону;
3) увеличение концентрации одного из исходных продуктов (H2) вызовет смещение равновесия в сторону его расхода, т.е. в сторону прямой реакции.
Задание 3. Равновесие в системе H2(г) + J2(г) ⇆ 2HJ(г) установилось при следующих концентрациях: [H2] = 0,025 моль/л; [J2] = 0,05 моль/л; [HJ] = 0,09 моль/л. Определите значение константы равновесия и исходные концентрации водорода и йода.
| Дано: [H2]равн=0,025 М [J2]равн=0,05 М [HJ]равн=0,09 М | Решение:
В соответствии с уравнением реакции для образования 2 моль HJ следует израсходовать 1 моль H2 и 1 моль J2. Так как образовалось 0,09 М НJ, следовательно, израсходовалось 0,045 М H2 и J2.
[H2]исх=[H2]равн + [H2]изр.=0,025 М+0,047 М=0,07 М
[J2] исх=[ J2]равн + [J2]изр.=0,05 М+0,045 М= 0,095 М
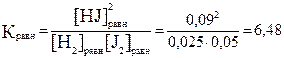
|
| Kравн –? [H2]исх–? [J2] исх –? |
Задания к самостоятельной работе
21. Приведите математическое выражение закона действующих масс для реакции 2CO(г) + O2(г) → 2CO2(г) и определите, во сколько раз изменится скорость реакции, если концентрацию оксида углерода (II) увеличить в 4 раза, а кислорода – уменьшить в 2 раза?
22. Как изменится скорость прямой реакции в системе 2NO(г) + O2(г) ⇆ 2NO2(г), если увеличить объём системы в 2 раза? Сместится ли при этом равновесие?
23. Приведите выражения для констант равновесия систем FeO(к) +CO(г) ⇆ Fe(к) + CO2(г); CH4(г) + CO2(г) ⇆ 2CO2(г) + H2(г). В каком направлении произойдёт смещение равновесий при понижении давления?
24. Определить равновесную концентрацию водорода в системе 2HJ ⇄ H2 + J2, если исходная концентрация HJ составляла 0,05 моль/дм3, а константа равновесия K= 0,02.
25. Равновесие в системе 2NO(г) + O2(г) ⇆ 2NO2(г) установилось при следующих концентрациях: [NO2] = 0,008 моль/л; [NO] = 0,03 моль/л. Найдите константу равновесия и исходную концентрацию NO2.
26. Две реакции при 30 0С протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй – 4. Найдите соотношение этих скоростей при 60 0С.
27. В сторону какой реакции сместится равновесие в системе 2 CO(г) + O2(г) ⇆ 2CO2 (г); Δ H= - 568 кДж при: а) увеличении давления; б) понижении температуры; в) введении дополнительного количества CO2? Почему? Какой вид имеет константа равновесия?
28. Какие параметры можно изменить, чтобы добиться смещения равновесия в системе 4HCl(г) + O2(г) ⇆ 2Cl2(г) + 2 H2O (г); Δ H= - 116,4 кДж в сторону исходных веществ? Дайте необходимые пояснения и приведите выражение для константы равновесия.
29. Какие параметры можно изменить, чтобы добиться смещения равновесия в системе СO(г) + H2O (г) ⇆ CO2(г) + H2 (г); Δ H= - 42,6 кДж в сторону исходных веществ? Дайте необходимые пояснения и приведите выражение для константы равновесия.
30. Какие параметры можно изменить, чтобы добиться смещения равновесия в системе С(графит) + СO2 (г) ⇆ 2CO (г); Δ H= - 172,5 кДж в сторону исходных веществ? Дайте необходимые пояснения и приведите выражение для константы равновесия.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 6462; Нарушение авторских прав?; Мы поможем в написании вашей работы!