
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакція з калій гексаціанофератом (II, III) K4Fe(CN)6], K3Fe(CN)6]
|
|
|
|
Контрольні питання.
Лабораторна робота №1 Якісні реакції катіонів І-ІІ груп.
Мета: ознайомитися із якісними реакціями на катіони І-ІІ груп у розчинах та мікрокристалоскопічно.
Обладнання та посуд: набір реактивів для проведення якісних реакцій на катіони, пробірки, предметне скло, скляна паличка, мікроскоп, центрифуга, електрична плитка.
Завдання:
1. У даній лабораторній роботі пропонується виконати наступні якісні реакції катіонів I-ІІ груп
2. Провести систематичний аналіз суміші катіонів I-ІІ груп. Рівняння реакцій записати в лабораторний журнал.
1. Які групові реагенти використовують для відкриття І та ІІ аналітичної групи катіонів?
2. За допомогою яких реакцій можна визначити катіони K+, Na+? Наведіть приклади реакцій.
3. За допомогою яких реакцій можна визначити катіони NH4+? Наведіть приклади реакцій.
4. За допомогою яких реакцій можна визначити катіони Ва2+, Ca2+, Mg2+, Mn2+?
5. За допомогою яких реакцій можна визначити катіони Sr2+, Аl3+, Cr2+, Bi2+?
6. За допомогою яких реакцій можна визначити катіони Fe2+, Fe3+?
7. Опишіть особливості аналізу суміші І та ІІ групи катіонів.
Катіони третьої аналітичної групи Cu2+, Cd2+, Hg2+, Co2+, Ni2+, Zn2+
Груповим реактивом є гідроксид амонію NH4OH, який в стехіометричних кількостях осаджує їх у вигляді гідроксидів, основних солей та амідів. При надлишку гідроксиду амонію вони розчиняються, тоді як фосфати катіонів другої аналітичної групи в надлишку аміаку нерозчинні. Більшість солей катіонів третьої групи малорозчинні у воді та багато з них забарвлені. Так розчинними є хлориди, окрім хлориду одновалентної міді, сульфати, нітрати, нітрити, ацетати. Малорозчинними є всі гідроксиди, гексаціаноферати (II, III), карбонати, оксалати, фосфати, арсенати, силікати, хромати, сульфіди. Забарвленими сполуками є всі солі та гідроксиди міді (II), кобальту, нікелю, ртуть йодид, всі сульфіди, за винятком цинк сульфіду, білого кольору, а також солі, що утворені забарвленими аніонами.
Реакції іонів Cu2+
Іони Си2+ з калій гексаціанофератом (II) утворюють червоно-бурий осад гексаціоноферату міді (ІІ) Cu2[Fe(CN)6]:

Осад не розчиняється в розведених кислотах, розкладається лугами, внаслідок чого утворюється блакитний осад гідроксиду міді (II) i розчиняється в розчині NH4OH з творенням аміакату міді:
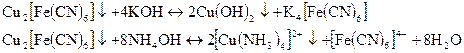
Взаемодія іонів Сu2+ з калій гексаціанофератом (III) K3[Fe(CN)6] приводить до утворення жовто-зеленого осаду Cu3[Fe(CN)6]:
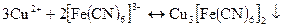
Осад не розчиняється в хлорид ній кислоті, але розчиняється в розчині аміаку.
Реакція з тіосульфтом натрію Na2S2O3. Сu2+- іони з тіосульфатом натрію в кислому середовищі при нагріванні утворюють чорний осад Cu2S:
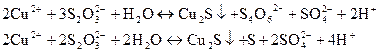
Цю реакцію використовують для відокремлення Сu2+-іонів від іонів Сd2+, оскільки іони кадмію при дії Н2S2О3 в кислому середовищі осаду СdS не утворюють.
Виконання реакції. До 10-15 крапель розчину в пробірці добавляють 2 н. розчин Н2SО4 до кислої реакції (рН  2), 2-3 кристалика Na2S2O3 і суміш нагрівають до кипіння.. В присутності іонів Сu2+ утворюється чорний осад Cu2S.
2), 2-3 кристалика Na2S2O3 і суміш нагрівають до кипіння.. В присутності іонів Сu2+ утворюється чорний осад Cu2S.
Дія калій йодиду КI. Іони Сu2+ окиснюють I--іони, при цьому Сu2+-іони відновлюються до міді (І), яка утворює білий осад СuI і виділяється вільний І2, який забарвлює розчин з осадом в бурий колір:

Дія калій тіоціанату КSСN. При взаємодії іонів Сu2+ з SCN--іонами утворюється чорний осад тіоціанату міді (IІ) Сu(SCN)2:

Осад Сu(SCN)2 поступово перетворюється в малорозчинний СuSCN білого кольору, при цьому виділяється родан (SCN)2.
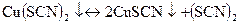
Якщо до розчину добавити відновник, наприклад Na2S2O3, то відновлення Сu(ІІ)до Сu(І) в осаді відбувається досить швидко і швидко змінюється забарвлення осаду від чорного до білого:

Дія амоній, тетрародано (тетратіоціанато) меркурата (II) (NH4)2[Hg(SCN)4] ІониСu2+ в присутності іонів Zn2+ з амоній тетрароданомеркуратом (II) (NH4)2[Hg(SCN)4] утворюють осад Cu[Hg(SCN)4]Zn[Hg(SCN)4], забарвлений у фіолетовий колір:

Реакції заважають іони Fе3+, Со2+, Ni2+, які за аналогічних умов утворюють забарвлені розчини.
Виконання реакції. До 1 краплі розчину у пробірку додають 2 - 3 краплі 1%-го розчину цинку сульфату ZnSO4, 1 - 2 краплі 2 н. розчину Н2SО4 i 1 краплю розчину (NH4)2[Hg(SCN)4] (8 г НgCl2 і 9 г NH4SCN розчиняють в 100 мл води). Суміш перемішують скляною паличкою. Поява осаду фіолетового кольору свідчить про присутність іонів Сu2+ в розчині.
Відновлення іонів Сu2+ металами: залізом, цинком, алюмінієм та іншими. Маючи досить високий окисно-відновний потенціал Е(Сu2+∕Сu0)=+0,34В іони Сu2+ відновлюються до Сu0 (металічної) металами, для яких окисно-відновні потенціали характеризуються меншими позитивними величинами: залізом, цинком; алюмінієм. Для них величини
 ;
;  ;
;  .
.
Тому, якщо занурити залізний цвях в розчин, в якому знаходяться іониСu2+, то останні відновлюються до металу і червоним осадом покривають залізний цвях:
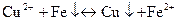
Реакції іонів Сu2+ з NH4OH, (NН4)2[Нg(SСN)4]+ZnSO4 та металічним залізом є характерними і їх застосовують для виявлення іонів Сu2+ в присутності інших металів.
Загальні реакції катіонів III третьої аналітичної групи. Дія гідрофосфатів лужних металів і амонію призводить до утворення білих осадів кадмію, цинку, ртуті (II), зелених – нікелю, фіолетових – кобальту, голубих – міді.
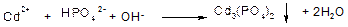

Осади гідрофосфатів і фосфатів катіонів III групи розчиняються в оцтовій і мінеральних кислотах:

Всі фосфати іонів III групи розчиняються в NH4OH, гідрофосфат та фосфат цинку розчиняється в розчині лугів:

Дія NН4ОН. Водний розчин аміаку осаджує Со(ОН)2 рожевого кольору, Ni(OH)2 зеленого кольору, Сd(ОН)2 і Zn(ОН)2 білого кольору, Сu(ОН)2 - зеленувато-синього кольору. Солі ртуті (II) утворюють білий осад НgNН2Сl амідосполуки. Гідроксиди металів і НgNН2С1 в надлишку NH4OH розчиняються і утворюють розчинні у воді аміакати: [Со(NН3)6]2+- брудно-жовтого, [Ni(НN3)6]2+-синього кольору, [Сu(NН3)6]2+-інтенсивно синього кольору, [Сd(NН3)4]2+[Zn(NН3)6]2+[Hg(NН3)4]2+-у водних розчинах безбарвні.

На повітрі розчин з [Со(NН3)6]2+-іонами поступово червоніє внаслідок окиснення і утворення аміачного комплексу кобальту (III):
4[Co(NH3)6]2++O2+2H2O↔4[Co(NH3)6]3++4OH-
Кислоти руйнують аміакати, при цьому утворюються NН4+-іони
[Co(NH3)6]2++6H+↔Co2++6NH4+
Дія розчинів лугів NаОH, КОН. Розчини лугів осаджують гідроксиди Со(ОН)2 Ni(ОН)2, Zn(ОН)2, Сd(ОН)2, Сu(ОН)2, Нg(ОН)2. Гідроксид ртуті (II) є нестійкою сполукою, яка розкладається з утворенням НgО жовтого кольору:
Hg(OH)2↓↔HgO↓+H2O
При дії NаОН+Н2O2 випадає гідроксид кобальту (III) Со(ОН)3. Внаслідок амфотерності Zn(ОН)2 розчиняється в надлишку лугу:
Zn(ОН)2↓+2ОН-↔[Zn(ОН)4]2-
В концентрованих лугах частково розчиняється і Сu(ОН)2 утворенням купритів:
Сu(ОН)2↓+2ОН-↔[Сu(ОН)4]2-
Діякарбонатів калію, натрію або амонію (МН4)2СО3. Розчини карбонатів лужних металів та амонію осаджують основні карбонати катіонів III групи: (СоОН)2СО3 - рожевою кольору, (NіОН)2СО3 - зеленого кольору, (ZnОН)2СО3 - білого кольору, (СoОН)2СО3 - білого кольору, (СuОН)2СО3 - зеленого кольору, (HgOH)2CO3 – червоного кольору.
Осади основних карбонатів катіонів III групи розчиняються в кислотах і pозчинах NH4OH:
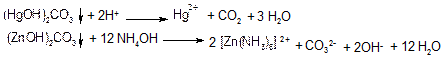
Дія сірководню H2S або амоній сульфіду (NH4)2S Сірководень та його солі утворюють з катіонами III групи осади сульфідів: СоS, NiS, СuS, НgS - чорного кольору, СdS - жовтого кольору, ZnS — білого кольору.

Сульфід цинку ZnS легко розчиняється в розведених мінеральних кислотах (ДРZnS=1,2∙10-23), сульфіди СоS, NiS і СdS розчиняються у відносно концентрований НСl і Н2S04 (ДРCoS = 2∙10-27, ДPNiS =2∙10-28, ДРCdS=3,6∙10-29), сульфід міді (II) СuS розчиняється в концентрованій HNO3 (ДРCuS=8,5 ∙10-45).
Дія окисників і відновників. До III групи відносяться катіони, які не дуже схильні до зміни своєї валентності, тому реакції окиснення-відновлення не характерні для них. Тільки при дії таких сильних окисників, як хлор, бром, гіпохлорит, гіпоброміт в лужному середовищі можна окиснювати Со2+ до Со3+, та при певних умовах іони Nі2+ бути окиснені до Nі3+-іонів. При певних умовах і при дії певних реактивів можна відновити іони Нg2+ до Нg22+ - іонів і навіть до металічної Нg, а також і Сu2+-іони до Сu+- іонів і до Сu0.
А сульфід ртуті (II) HgS (ДРНgS=4∙10-53) не розчиняється навіть в концентрованій HNO3, але розчиняється в суміші концентрованих НСІ+HNO3 або суміші НС1+Н2О2

Реакції іонів Со2+
Дія калій гексаціаноферату (II, III) К4[Fе(СN)6], К3[Fе(СN)6]. Калій гексаціаноферат (II) при взаємодії з іонами Со2+ утворює зеленуватий кобальт гексаціаноферат (II) Со2[Fе(СN)6].
Калій гексаціаноферат (III) при взаємодії з іонами Со2+ утворює бурувато-червоний кобальт гексаціаноферат (III) Со3[Fе(СN)6]2.
Дія амоній тіоціанату NH4SCN (КSСN). Тіоціанат-іони SCN- з іонами Со2+ утворюють забарвлену в синій колір комплексну сполуку (NН4)2[Со(SCN)4]:

Реакцію виконують в присутності ацетону або амілового спирту, в середовищі яких зменшується дисоціація комплексних іонів [Со(SCN)4]2- на іони Со2+ і SCN- і забарвлення внаслідок цього стає більш інтенсивним. Цій реакції заважають іони Fe3+ які з тіоціанат - іонами утворюють комплексну сполуку Fе(SCN)3, забарвлену в інтенсивно червоний колір і тому маскують забарвлення тіоціанатного комплексу кобальту. Тому, якщо в розчині присутні іони заліза, їх зв’язують в більш стійкий безбарвний комплекс [FеF6]3- додаванням амоній або натрій фториду.
Виконання реакції. До 2-3 крапель розчину, в якому виявляють іони Со2+, добавляють 2-3 кристалика сухої солі або 3-5 крапель насиченого розчину NH4SCN або KSCN, 8-10 крапель амілового спирту і суміш в пробірці збовтують. Забарвлення неводного шару в інтенсивно синій колір свідчить про наявність іонів Со2+ в розчині.
Замість амілового спирту до розчину можна добавити 10-15 см3 ацетону, при цьому в присутності іонів Со2+ весь розчин забарвлюється в синій колір.
Якщо розчин забарвлюється в червоний колір, то краплинами до розчину вносять насичений розчин NaF до зникнення червоного забарвлення. Синій колір розчину свідчить про наявність іонів Со2+.
Дія амоній тетрароданомеркурата (II) (NH4)2[Hg(SCN)4] Амоній тетрароданомеркурат (II) з іонами Со2+ утворює осад Со[Нg(SCN)4] синього кольору. У присутності іонів Zn2+ випадає осад блакитного кольору, склад якого відповідає формулі Со[Hg(SCN)4]Zn[Hg(SCN)4]
Виконання реакції. До 1-2 крапель слабкокислого розчину добавляють 1 краплю розчину цинку, 2-3 краплі розчину (NH4)2[Hg(SCN)4] і збовтують суміш. Поява осаду блакитного кольору свідчить про присутність іонів Со2+.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 3169; Нарушение авторских прав?; Мы поможем в написании вашей работы!