
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення концентрації розчину соляної кислоти
|
|
|
|
Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
Мета: Визначити концентрацію HCl за натрій тетраборатом.
Обладнання та посуд:.
1 Бюретка, 25 мл.
2. Колба для титрування.
3. Лійка
4. Мірний циліндр,100мл.
5. Натрій тетраборат.
6. Індикатор - метиловий червоний.
Завдання:
Визначення концентрацію соляної кислоти за натрій тетраборатом.
Щоб визначити концентрацію розчину кислоти, застосовують такі вихідні речовини: Na2B4O7·10H2O - натрій тетраборат, Na2CO3 - натрій карбонат, KHCO3 – калій гідрокарбонат, KIO3 – калій іодат та ін. 
Принцип методу. Для визначення концентрації HCl застосовують метод окремих наважок. При титруванні натрій тетраборату хлоридною кислотою відбуваються реакції:
Na2B4O7+7H2O→2NaOH+4H3BO3
2NaOH+2HCl→2NaCl+2H2O
----------------------------------------------------------
Na2B4O7+2HCl+5H2O→4H3BO3+2NaCl
Для визначення точки еквівалентності, застосовують індикатор, показник титрування (рТ) якого близький до рН у точці еквівалентності. У точці еквівалентності розчин містить тільки хлорид натрію (рН=7) та борну кислоту Н3ВО3, яка зумовлює слабо кислу реакцію розчину. Значення рН розчину у точці еквівалентності можна розрахувати за формулою для обчислення рН розчинів слабких кислот:
pH= 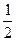 рК1 (H3BO3 ) −
рК1 (H3BO3 ) − 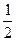 lgC(H3BO3),
lgC(H3BO3),
pK1(H3BO3)=−lgK1(H3BO3), pK1(H3BO3)=9,24,
C(H3BO3)=0,1M, pH= 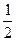 ·9,24 −
·9,24 − 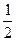 lg10-1=5,12
lg10-1=5,12 
Титрування буде більш точним тоді, коли застосувати індикатор з показником титрування 5,12 або близьким до цього значення. Таке значення рН у точці еквівалентності відповідає показнику титрування метилового червоного (рТ=5,5).
Обчислення маси наважки. Натрій тетраборат має перевагу при використанні його для встановлення концентрації НСl, тому що має велику молярну масу еквівалента.
M (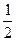 Na2B4O7 · 10H2O)=
Na2B4O7 · 10H2O)= 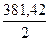 =190,71
=190,71 
Hаважку обчислюють з огляду на рівність кількості моль-еквівалентів реагуючих речовин, а саме:
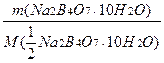 =
= 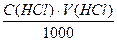
Концентрація кислоти (НСl)0,1М, об'єм кислоти беруть такий, щоб на титрування було достатньо однієї заповненої бюретки. Якщо користуються бюреткою на 25 мл, то для обчислення наважки беруть 20,0 мл:
m (Na2B4O7·10H2O)= 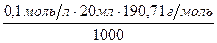 =0,38г.
=0,38г.
Хід аналізу. Наважку натрій тетраборату близько 0,38 г зважують на аналітичних терезах, висипають її в колбу для титрування, розчиняють у гарячій воді приблизно 50 мл. Розчин охолоджують до кімнатної температури, додають 1-2 краплі метилового червоного і титрують розчином НСl до зміни забарвлення розчину від жовтого до червоного.
Титрування проводять тричі. Концентрацію хлоридної кислоти розраховують за формулою:
C(HCl)= 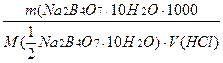
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 2103; Нарушение авторских прав?; Мы поможем в написании вашей работы!