
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольні питання
|
|
|
|
Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
Контрольні питання.
1. Які вихідні речовини використовують для встановлення нормальності кислот? Їх переваги та недоліки.
2. Розрахуйте яку наважку натрію тетраборату потрібно взяти для встановлення молярності ~0,5 М розчину соляної кислоти.
3. За яким методом концентрація НСl буде визначена точніше – методом пипетування чи методом окремих наважок?
4. Обчисліть рН в точці еквівалентності.
5. Чи впливає температура на результати титрування?
Мета: Приготувати розчин натрію гідроксиду з наважки та визначити його концентрацію за оксалатовою кислотою. Визначити масову частку лимонної (винної) кислоти.
Обладнання та посуд:.
1. Бюретка, 25 мл.
2. Мірна колба, 250 (200) мл.
3. Піпетка, 25 (20) мл.
4. Колба для титрування, 300мл.
5. Оксалатова кислота.
1. Індикатор – фенолфталеїн.
Завдання:
1. Приготувати розчин натрію гідроксиду.
2. Визначити концентрацію натрію гідроксиду за оксалатовою кислотою.
3. Визначити масову частку лимонної (винної) кислоти.
Приготування розчину натрію гідроксиду. Приготувати титрований розчин натрій гідроксиду розчиненням точної наважки NaOH неможливо, оскільки NaOH не відповідає вимогам вихідної речовини.
Їдкий натр являє собою кристалічну речовину білого кольору, яка поглинає вологу (тому на повітрі розпливається) і легко реагує з CO2 повітря з утворенням Na2CO3. Тобто, склад натрію гідроксиду невідомий, тому що він забруднений деякою кількістю карбонату натрію і води.
Для приготування титрованого розчину натрію гідроксиду спочатку готують розчин приблизної концентрації, а точну концентрацію визначають за вихідною речовиною, або за титрованим розчином кислоти. Для визначення органічних кислот зазвичай готують приблизно 1 М розчин натрію гідроксиду. Наважку NaOH, необхідну для приготування розчину, розраховують за формулою:
m(NaOH)= 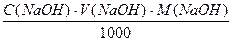 ; M(NaOH)=40
; M(NaOH)=40 
Якщо необхідно приготувати 500 мл 1 М розчину NaOH, то:
Vконц(NaOH)= 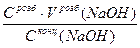
Розчин NaOH потрібної концентрації можна отримати і шляхом розбавлення більш концентрованого розчину лугу. В цьому випадку спочатку вимірюють густину концентрованого розчину лугу, за таблицею (довідник) знаходять молярну концентрацію розчину лугу і розраховують об'єм за формулою:
Визначення концентрації розчину натрій гідроксиду за оксалатовою кислотою Оксалатова кислота задовольняє вимогам вихідних речовин і реагує з NaOH за рівнянням:
Н2С2О4+2NaOH→Na2C2O4+2Н2О
Оксалатова кислота є слабкою кислотою (К1=6,5∙10-2, К2=6,1∙10-5). Вона титрується як двоосновна кислота, але на кривій титрування помітний лише один стрибок рН, так як К1⁄К2<104. Визначення концентрації розчину натрій гідроксиду за оксалатовою кислотою здійснюють методом піпетування. Наважку кислоти розраховують з огляду на рівність кількості моль-еквівалентів Н2С2О4 ·2Н2О та NaOH
n(H2C2O4)=n(NaOH)
 =
= 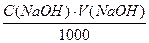
Молярна маса еквівалента оксалатової кислоти дорівнює половині молярної маси, тобто 126,07⁄2=63,04 г⁄моль.
Якщо Vk (об'єм колби)=250 мл, а Vп (об'єм піпетки)=25 мл, і титрують із бюретки 25,0 мл, то
m(H2C2O4 ∙2H2O) =  =12,5г.
=12,5г.
При титруванні оксалатової кислоти розчином натрій гідроксиду у точці еквівалентності розчин містить натрій оксалат, який гідролізує за першим ступенем, що обумовлює відповідну кислотність розчину:
С2O42- + H2O → HC2O4- + OH-
Гідроліз за другим ступенем незначний, тому
pH=7+ 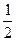 lgK2
lgK2 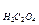 +
+ 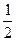 lgCсолі
lgCсолі
Таким чином, для фіксації точки еквівалентності при титруванні оксалатової кислоти розчином натрій гідроксиду слід використовувати фенолфталеїн (рТ=9) як індикатор.
Хід аналізу. Наважку оксалатової кислоти (Н2С2О4·2Н2О) близько 12,5 г зважують на аналітичних терезах, переносять у мірну колбу і розчиняють у дистильованій воді. Після повного розчинення оксалатової кислоти розчин доводять водою до мітки, ретельно перемішують. Відбирають піпеткою 20 (25) мл аліквотну частку (Vп) розчину, переносять її в колбу для титрування, розбавляють водою приблизно до 50 мл, добавляють 7-8 крапель фенолфталеїну і титрують розчином NaOH, концентрацію якого визначають, до появи рожевого забарвлення, яке не зникає протягом 20-30с. Титрування повторюють 3-4 рази. Концентрацію NaOH розраховують за формулою.
C(NaOH)= 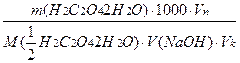
Визначення масової частки лимонної (винної) кислоти. Метод заснований на нейтралізації лимонної (винної) кислоти 1 н. розчином натрію гідроксиду в присутності фенолфталеїну.
Хід аналізу: на аналітичних терезах зважують приблизно 2 г наважки кислоти з точністю 0,0002г. Наважку кількісно переносять в конічну колбу місткістю 250см3 і розчиняють в 50 см3 дистильованої води. Додають до розчину 3-5 крапель фенолфталеїну і титрують 1М розчином натрію гідроксиду до появи слабко рожевого забарвлення, яке не зникає протягом 1 хвилини.
Масову частку кислоти W (у %) розраховують за формулою:
W(кислоти)= 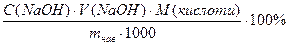 ;
;
1. Чому неможливо приготувати титрований розчин натрій гідроксиду розчиненням точної наважки NaOH?
2. Якими домішками може бути забруднений NaOH?
3. Розрахуйте яку наважку натрію оксалатової кислоти потрібно взяти для встановлення молярності ~1 М розчину NaOH.
4. За яким методом концентрація NaOH буде визначена точніше – методом пипетування чи методом окремих наважок?
5. Обчисліть рН в точці еквівалентності.
6. Чому для титрування лимонної або винної кислоти необхідно як індикатор використовувати фенолфталеїн?
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 647; Нарушение авторских прав?; Мы поможем в написании вашей работы!