
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторно-практическое занятие №7
|
|
|
|
Тема: Извлечение флавоноидов.
Цель: Выделить флавоноидов из растений и проведение с ними качественных реакции.
Опыт №1 Извлечение катехинов из зеленого чая
Дубильные вещества чая представляют собой смесь нескольких катехинов и их эфиров. Главные компоненты смеси: эпикатехин, галлокатехин, их эфиры с галловой кислотой. Например, танины из листьев цейлонского чая содержат эпикатехин (6,5%о), галлокатехин (24,2%), эпикатехингаллат (9%) и галлокатехингаллат (49%). Самих же танинов в зеленом чайном листе —22—24°/о, в черном чае —14—17% от веса сухих веществ. Катехины чая — негидролизующиеся дубильные вещества. От нагревания с разбавленными кислотами они превращаются в нерастворимые продукты уплотнения, так называемые флобафены. Обладают Р-витаминным характером, т. е. являются капилляроукрепляющими препаратами и вместе с тем способствуют накоплению аскорбиновой кислоты в организме.
Оборудование и реактивы:
1) Коническая колба.
2) Водяная баня.
3) Воронка и фильтр.
4) Штатив с пробирками.
5) Зеленый чай.
6) Ацетат свинца.
7) 1% раствор серной кислоты.
8) Этилацетат.
9) Водный раствор хлорного железа.
10)Раствор ванилина.
11)Концентрированная соляная кислота.
Ход работы.
Неферметированный чай загружают в коническую колбу (500 мл), заливают 300 мл горячей воды и нагревают 1 час на кипящей водяной бане. Раствор отфильтровывают через полотняный фильтр на фарфоровой воронке, а остаток обрабатывают повторно водой. К объединенному экстракту добавляют ацетат свинца до полного осаждения таната свинца. Темный осадок отфильтровывают, промывают водой, обрабатывают 1-процентным раствором серной кислоты до явно кислой реакции. Сульфат свинца отфильтровывают, раствор промывают три раза этилацетатом (порциями по 20 мл). Этилацетат отгоняют на водяной бане; остаток высушивают. Полученный танин измельчают в порошок и взвешивают. Выход 3—4 г. Танин из зеленого чая представляет собой аморфный порошок, легко растворимый в воде и спирте.
Качественные реакции. Часть танина растворяют в воде, раствор разливают в три пробирки и проводят качественные реакции, доказывающие его принадлежность к дубильным веществам катехинового ряда.
1. С водным раствором хлорного железа—зелено-черное окрашивание.
2. С раствором ванилина в соляной кислоте — малиновое окрашивание.
3. Нагревание пробы с каплей концентрированной соляной кислоты — красный осадок флобафена.
Опыт № 2. Количественное определение суммы флавоноидов в пересчете на рутин травы зверобоя продырявленного, собранной в разные фазы вегетации: бутонизации, цветения, плодоношения, увядания
Аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм. Около 1 г (точная навеска) измельченного сырья помещают в колбу со шлифом вместимостью 150 мл, прибавляют 30 мл 50 % спирта. Колбу присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 30 мин., периодически встряхивая для смывания частиц сырья со стенок. Горячее извлечение фильтруют через вату в мерную колбу вместимостью 100 мл так, чтобы частицы сырья не попадали на фильтр. Вату помещают в колбу для экстрагирования и прибавляют 30 мл 50 % спирта. Экстракцию повторяют еще дважды в описанных выше условиях, фильтруя извлечение в ту же мерную колбу. После охлаждения объем извлечения доводят 50 % спиртом до метки и перемешивают (раствор А).
В мерную колбу вместимостью 25 мл помещают 1 мл раствора алюминия хлорида в 95 % спирте и доводят объем раствора 95 % спиртом до метки. Через 40 мин. измеряют оптическую плотность раствора на спектрофотометре при длине волны 415 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют раствор, состоящий из 1 мл извлечения, 1 капли разведенной уксусной кислоты и доведенной 95% спиртом до метки в мерной колбе вместимостью 25 мл.
Параллельно измеряют оптическую плотность раствора Государственного стандартного образца (ГСО) рутина, приготовленного аналогично испытуемому раствору.
Содержание суммы флавоноидов в перерасчете на рутин и абсолютно сухое сырье в процентах (X) вычисляют по формуле (1.2.3):
X = 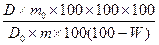 (1.2.3),
(1.2.3),
где D – оптическая плотность испытуемого раствора; D0 – оптическая плотность ГСО рутина; m – масса сырья, г; m0 – масса ГСО рутина, г; W – потеря в массе при высушивании сырья, %.
Примечание: Приготовление раствора Государственного стандартного образца (ГСО) рутина: около 0,05 г (точная навеска) ГСО рутина, предварительно высушенного при температуре 130-135 °С в течение 3 ч, растворяют в 85 мл 95 % спирта в мерной колбе вместимостью 100 мл при нагревании на водяной бане, охлаждают, количественно переносят в мерную колбу вместимостью 100 мл, доводят объем раствора тем же спиртом до метки и перемешивают.
Результаты:
D0 = 0,335
m0 = 0,05
Период бутонизации:1) m1 = 1,1166
D1 = 0,325
W1 = 7,72 %
X = 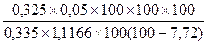 = 4,71 %
= 4,71 %
Период цветения: 1) m2 = 1,0024
D2 = 0,394
W2 = 5,94 %
X = 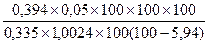 = 6,24 %
= 6,24 %
Период плодоношения: 1) m3 = 1,0107
D3 = 0,337
W3 = 6,05 %
X = 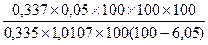 = 5,3 %
= 5,3 %
Период увядания: 1) m4 = 1,0183
D4 = 0,324
W4 = 5,53 %
X = 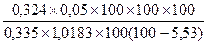 = 5,03 %.
= 5,03 %.
Опыт № 3 Качественное обнаружение флавоноидов в образце череды трехраздельной.
Для качественного обнаружения флавоноидов в исследуемом объекте - траве череды трехраздельной - готовим спиртовое извлечение. Для этого в колбу с притертой пробкой вместимостью 25 мл помещают 0,5 г измельченного сырья, прибавляют 5 мл 70 % спирта. Колбу присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 20 мин. Содержание колбы охлаждают до комнатной температуры и фильтруют через бумажный фильтр (раствор Б).
На полоску хроматографической бумаги FN 12 (ГДР) наносят микропипеткой 0,02 мл раствора Б. Бумагу подсушивают на воздухе и хроматографируют при комнатной температуре в вертикальной камере, предварительно насыщенной в течение 24 ч смесью растворителей н-бутиловый спирт-уксусная кислота - вода (4:1:2). Через 16 ч хроматограмму вынимают, сушат до полного исчезновения запаха растворителей и просматривают в УФ-свете при длине волны 360 нм. На хроматограмме должно быть два темно-коричневых пятна с Rf около 0,38 и 0,58 (флавоноиды). Не допускается наличие темно-коричневого пятна с Rf около 0,75 (примесь череды поникшей).
Библиография
1. Алейникова Т. Л. Руководство к практическим занятиям по биологической химии. М.: Высшая школа, 1988. – 189с.
2. Березов Т. Т., Коровкин Б. Ф. Биологическая химия. – М.: Просвещение, 1990. – 524с.
3. Зинковский А. Ф. Практикум по биологической химии для студентов.- Ульяновск, 1984. - 236с.
4. Каспржак А. Г. Элективные курсы в профильном обучении. – М.: Просвещение, 2004. – 97с.
5. Колотилова Л. И. Витамины. – М.: Высшая школа, 1976. – 254с.
6. Лазурьевский Г. В., Терентьева И. В., Шамшурин А. А. Практические работы по химии природных соединений.- М.: Высшая школа, 1961. – 191с.
7. Ленинджер А. Основы биохимии; В 3 т. М.: Мир, 1985. Т. 1-3. - 1056 с.
8. Логинова О. Б. От «углубленки» к профильному обучению// Химия в школе. 2006. № 32. - с. 14 - 17.
9. Макаров К. А. Химия и медицина. – М.: Просвещение, 1981.- 164с.
10. Меньшиков В. В. Биохимия.- М.: Просвещение, 1986. - 489с.
11. Наливайко Л. П., Астафьев В. М., Наливайко И. В. Биологическая химия с основами экологии: Часть II.- Самара: Изд-во СамГПУ, 2001. – 72с.
12. Овчинников Ю.А. Биоорганическая химия. М.: Просвещение, 1987. - 815с.
13. Панфилова Л. В. Химия окружающей среды: Часть 4. Органическая химия.- Самара: СИПКРО, 2000. - 50с.
14. Пустовалова Л. М. Практикум по биохимии.- Ростов-на-Дону: издательство «Феникс», 1999. – 544с.
15. Руководство к лабораторным занятиям по органической химии: Пособие для вузов/ Н. Н. Артемьева, В. Л. Белобородов, С. Э. Зурабян и др. – М.: Дрофа, 2002. – 384с.
16. Страйер Л. Биохимия: В 3 т. М.: Мир, 1984 - 1985. Т. 1- 3. - 936 с.
17. Файгль Ф. Капельный анализ органических веществ.- М.: Госхимиздат, 1962. – 836с.
18. Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1985. – 503с.
19. Филиппович Ю. Б. Практикум по биохимии.- М.: Просвещение, 1982. – 311с.
20. Черникова Н. Г. Профильное обучение. – М.: ТЦ Сфера, 2006. – 293с.
Приложение 1.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 882; Нарушение авторских прав?; Мы поможем в написании вашей работы!