
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л
|
|
|
|
Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2моль-2•с –1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В.
Решение. Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере V= K*CA2* CB
Скорость химической реакции в начальный момент равна:
V=0,5. 62. 5 = 90,0 моль. с-1. л-1
По истечении некоторого времени в реакционной смеси останется 45 % вещества В, т. е. концентрация вещества В станет равной 5. 0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25= 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2: 1, то концентрация вещества А уменьшилась нa 5,5 моль/л (2,75 . 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, V2 = 0,5(0.5)2 • 2,25 = 0,28 моль. с-1 . л-1.
Ответ: 0,28 моль. с-1 . л-1
Задача 2. Как изменится скорость прямой реакции 2СО + О2 = 2СО2
если общее давление в системе увеличить в 4 раза?
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Это вытекает из газовых законов, в соответствии с которыми, давление прямо пропорционально концентрации газа в объеме.
PV=  . Так как молярная концентрация вещества См (моль/л) определяется как отношение количества вещества (моль) к объему, то Р =
. Так как молярная концентрация вещества См (моль/л) определяется как отношение количества вещества (моль) к объему, то Р =  .
.
Согласно закону действующих масс начальная скорость реакции равна V1 = 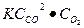 .
.
После увеличения давления в 4 раза, концентрация каждой компоненты вырастит в 4 раза. Тогда V2= k  = 43
= 43 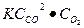 = 64
= 64 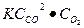 = 64V1
= 64V1
Следовательно, после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Ответ: скорость реакции возросла в 64 раза.
Задача 3. Константа скорости реакции А + 2В 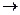 3С равна 0,6 л2 моль-2 с-1. Исходные концентрации веществ А и В составляли по 0,75моль/л. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация веществ А и С, начальную скорость и скорость прямой реакции, когда концентрация вещества В стала 0,5 моль/л.
3С равна 0,6 л2 моль-2 с-1. Исходные концентрации веществ А и В составляли по 0,75моль/л. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация веществ А и С, начальную скорость и скорость прямой реакции, когда концентрация вещества В стала 0,5 моль/л.
Решение. Начальную скорость реакции считаем, пользуясь законом действующих масс:
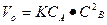 = 0,6
= 0,6  0,75
0,75  (0,75)2= 0,6
(0,75)2= 0,6  (0,75)3= 0,253 моль
(0,75)3= 0,253 моль  л-1
л-1  с-1.
с-1.
Допустим, имеем один литр реакционной смеси. Следовательно, в реакционной смеси имеем по 0,75 моль исходных реагентов. Когда концентрация вещества В стала 0,5 моль/л, значит в реакцию вступило 0,75 - 0,5 = 0,25 моль вещества В. Так как вещества А и В реагируют в мольных отношениях 1: 2, то изменение концентрации вещества А при этом составит 0,5  0,25= 0,125 моль. Следовательно, в системе останется 0,75 – 0,125 = 0,625 моль вещества А.
0,25= 0,125 моль. Следовательно, в системе останется 0,75 – 0,125 = 0,625 моль вещества А.
Рассчитаем скорость реакции. V1= 0,6  0,625
0,625  (0,5)2= 0,09375 моль
(0,5)2= 0,09375 моль  л-1
л-1  с-1.
с-1.
Вещество С образуется в мольном отношении к веществу А равному 3:1, следовательно при расходе вещества А 0,125 буде образоваться 3  0,125= 0,375 моль вещества С. Так как в начале реакции в реакционной системе отсутствовало вещество С, то его концентрация будет 0,375 моль/л.
0,125= 0,375 моль вещества С. Так как в начале реакции в реакционной системе отсутствовало вещество С, то его концентрация будет 0,375 моль/л.
При сопоставлении значений скорости реакции в начальный момент и после превращения, то окажется, что скорость реакции по ходу уменьшилась в 0,253:0,09375= 2,7 раза. Такая закономерность обусловлена тем, что во времени происходит расходование исходных веществ. А по закону действующих масс, скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Ответ: скорость реакции уменьшилась в 2,7 раза.
Задача 4: На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
Решение: В соответствии с правилом Вант – Гоффа.
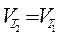
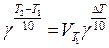 ;
;  ;
; 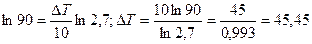
Ответ: Для того, чтобы скорость реакции возросла в 90 раза, необходимо повышать температуру реакционной смеси на 45,450С.
Задача 5: При 100С реакция заканчивается за 95с, а при 200С за 60с. Вычислить энергию активации этой реакции.
Ответ: Чем дольше протекает реакция, тем она медленнее и наоборот. Поэтому, время реакции,  . Скорость реакции при 100С обозначим через V1, а при 200С - V2. Тогда
. Скорость реакции при 100С обозначим через V1, а при 200С - V2. Тогда 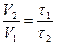 .
.
Взаимосвязь константы скорости реакции с энергией активации определяется уравнением Аррениуса:
К= 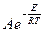 или, как иногда упрощенно пишут К=Аехр(-
или, как иногда упрощенно пишут К=Аехр(-  ),
),
где А - предэкспоненциальный множитель, зависит от типа реакции, Е- энергия активации (кДж/моль), также зависит от типа реакции и не зависит от температуры. Таким образом, константа скорости реакции зависит от типа реакции (А и Е) и от температуры (T).
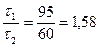
 . С другой стороны
. С другой стороны 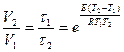 = 1,58.
= 1,58.
ln1,58= 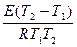 ; E=
; E= 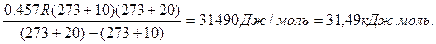
Ответ: 31,49 кДж/моль.
Задача 6: Через некоторое время после начала реакции 3А + В 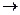 2С +D концентрация веществ А, В и С составляли (моль/л) 0,03; 0,01; 0,008 соответственно. Каковы исходные концентрации веществ А и В?
2С +D концентрация веществ А, В и С составляли (моль/л) 0,03; 0,01; 0,008 соответственно. Каковы исходные концентрации веществ А и В?
Решение: Допустим, что имеем один литр реакционной смеси, в которой в начале реакции отсутствовали вещества С и D. Так как за время реакции образовалось 0,008 моль вещества С, то за это время прореагировало два раза меньше вещества В (в соответствии с уравнением реакции). Таким образом, исходная концентрация вещества В составляла 0,01 + 0,004= 0,014моль/л. Если прореагировало 0,004 моль вещества В, то по уравнению реакции в это же время прореагировало 3 раза больше вещества А, то тесть 0,004  3=0,012 моль. Так как осталось 0,03 моль вещества А, то его начальная концентрация составляла 0,03+ 0,012= 0,042 моль/л.
3=0,012 моль. Так как осталось 0,03 моль вещества А, то его начальная концентрация составляла 0,03+ 0,012= 0,042 моль/л.
Задача 7: Рассчитать константу скорости реакции первого порядка, учитывая, что за 25 мин реакция проходит на 25%.
Решение: Дифференциальное уравнение для реакций первого порядка, а именно реакции, протекающие по схеме: А 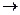 В, имеет вид:
В, имеет вид:
-  . Знак минус показывает, что рассматриваем процесс уменьшения концентрации вещества А во времени. Преобразуем это дифференциальное уравнение и проинтегрируем в неопределенных условиях:
. Знак минус показывает, что рассматриваем процесс уменьшения концентрации вещества А во времени. Преобразуем это дифференциальное уравнение и проинтегрируем в неопределенных условиях:
 , -lnCA= Kt + соnst. При t=0, соnst =- lnCoA и
, -lnCA= Kt + соnst. При t=0, соnst =- lnCoA и  .
.
Отсюда
 ,
,  .
.
Ответ: K1 = 1,15 * 10-3 сек-1
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 7293; Нарушение авторских прав?; Мы поможем в написании вашей работы!