
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. Определите массовую долю в (%) хлорида калия в растворе, содержащем 0,053 кг KCI в 0,5 л раствора
|
|
|
|
Задача 1. Определите массовую долю в (%) хлорида калия в растворе, содержащем 0,053 кг KCI в 0,5 л раствора, плотность которого 1063 кг/м3.
Решение. Массовую долю вещества находим по формуле
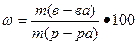 %
%
где m(в-ва), масса вещества, г;
m(р-ра), масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность ρ
m=Vρ, тогда 
массовая доля хлорида калия в растворе равна:
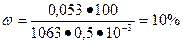 .
.
Ответ: 10%.
Задача 2. Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение. Молярную концентрацию вещества находят по формуле

где ν(в-ва), количество вещества, моль;
V(р-ра), объем раствора, л.
Количество вещества ν вычисляют по формуле
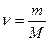
где m, масса вещества, г;
М, молярная масса вещества, г/моль.
Тогда масса NaOH, содержащегося в растворе, равна

Ответ:0,8 г.
Задача 3. Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы C6H12O6 при 0 0С.
Решение. Осмотическое давление вычисляют по формуле
 ,
,
где ν, количество вещества, моль;
R, газовая постоянная, равная 8,314 Дж/(моль·К);
Т, абсолютная температура, К;
V, объем раствора, м3.
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно в 1,4 л раствора содержится ν= 63/180,16=0,35 моль глюкозы. Осмотическое давление этого раствора глюкозы:

Ответ: 5,67 * 105 Па.
Задача 4. Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11, в 45,05 г воды при 65 0С, если давление паров воды при этой температуре равно 2,5•104 Па.
Решение. Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
 ,
,
где P0, давление пара над чистым растворителем;
P, давление пара растворителя над раствором;
n, количество растворенного вещества, моль;
N, количество растворителя, моль.
М (C12H22O11)=342,3 г/моль;
М (H2O)=18,02 г/моль.
Давление пара над раствором:
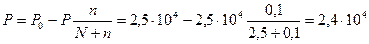 Па
Па
Ответ: 2,4 * 104 Па.
Задача 5. Раствор камфоры массой 0,552 г в 17 г эфира кипит при температуре на 0,4610 выше, чем чистый эфир. Эбулиоскопическая константа эфира 2,16 0С. Определите молярную массу камфоры.
Решение. Молекулярную массу камфоры определяем пользуясь соотношением

Молекулярная масса камфоры равна 155,14
Задача 6. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при -20 С?
Решение: В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного неэлектролита:

По условию задачи 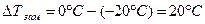 . Зная криоскопическую постоянную воды (1,86
. Зная криоскопическую постоянную воды (1,86 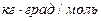 ), можно найти моляльную концентрацию раствора этилового спирта:
), можно найти моляльную концентрацию раствора этилового спирта:
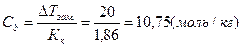
Иными словами в одном килограмме воды содержится 10,75 моль этилового спирта, масса которого равна:
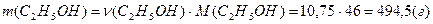
Отношение масс воды и этилового спирта равно:
1000:494,5 = 2:1
Ответ: Отношение масс воды и этилового спирта 2:1.
Задача 7. В радиатор автомобиля налили 9 л воды и прибавили 2 л метанола (плотность 0,8 г/мл). При какой температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет?
Решение: В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного неэлектролита:
 или
или 
Принимая во внимание, что плотность воды близка к 1 г/мл, а плотность метанола равна 0,8 г/мл, можно от объемов перейти к массам:

Учитывая, что 
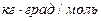 , а
, а 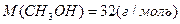 имеем:
имеем: 
Таким образом, вода в радиаторе будет замерзать при температуре -5,55  , поэтому автомобиль не рекомендуется оставлять на открытом воздухе при данной и более низких температурах.
, поэтому автомобиль не рекомендуется оставлять на открытом воздухе при данной и более низких температурах.
Ответ: 5,55 0С.
Задача 8. При какой температуре замерзнет «водка», если принять, что водка – это 40% (объемных) раствор этанола в воде. Плотность этанола принять за 0,8г/см3. Плотность водки принять за 0,94г/см3.
Решение. Воспользуемся уравнением  . Допустим, имеем 100 мл или 100
. Допустим, имеем 100 мл или 100  0,94=94 грамм водки. В этом объеме содержится 40 мл (или 40
0,94=94 грамм водки. В этом объеме содержится 40 мл (или 40  0,8=32г) этанола, с молярной массой 46г/моль.Так4им образом, в 100мл водки содержится 32г этанола и 94-32=62г воды. Подставим эти значения в уравнение.
0,8=32г) этанола, с молярной массой 46г/моль.Так4им образом, в 100мл водки содержится 32г этанола и 94-32=62г воды. Подставим эти значения в уравнение.
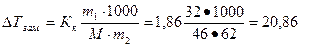
Таким образом, водка может замерзать при температуре окружающей среды ниже -20,86оС.
Ответ: -20,86оС.
Задача 9. Вычислите растворимость BaCI2 в воде при 0 0С, если при этой температуре в 13,1 г раствора содержится 3,1 г BaCI2.
Решение. Растворимость (или коэффициент растворимости) выражают массой вещества, которое можно растворить в 100 г воды при данной температуре. Масса раствора BaCI2 13,1 г. следовательно, в 10 г растворителя при 0 0С содержится 3,1 г BaCI2. растворимость BaCI2 при 0 0С равна 100·3,1/10=31 г.
Задача 10. Растворимость Ag3PO4 (Mч=418,58) в воде при 20 0С равна 0,0065 г/л. Рассчитайте значение произведения растворимости.
Решение. Растворимость Ag3PO4 равна
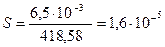 моль/л.
моль/л.
При диссоциации 1 моль Ag3PO4 образуется 3 моль ионов Ag+ и 1 моль ионов PO43-, поэтому концентрация иона PO43- равна растворимости Ag3PO4, а концентрация иона Ag+ в 3 раза больше, т.е.
С(PO43-)= 1,6·10-5 моль/л; С(Ag+)= 3·1,6·10-5 моль/л.
Произведение растворимости Ag3PO4 равно
ПР=С3(Ag+)· С(PO43-)=(4,8·10-5)3·1,6·10-5=1,77·10-18.
Ответ: 1,77 * 10-18
Задача 11. Рассчитать концентрации катионов кальция и фосфат анионов в насыщенный растворе отрофосфата кальция Са3(РО4)3, если ПР[ Са3(РО4)2 ]= 10-29?
Решение: Мало растворимая соль ортофосфат кальция в воде слабо диссоцирует:
Са3(РО4)2  3Са2+ + 2РО43-
3Са2+ + 2РО43-
ПР[ Са3(РО4)2] = [Са2+]3  [РО43-]2 = 10-29
[РО43-]2 = 10-29
Допустим, в одном литре насыщенного раствора этой соли диссоциации подверглась Х моль фосфата кальция. При этом, образовались 3Х моль катионов кальция и 2Х моль фосфат анионов. Подставим эти значения в выражении ПР.
ПР[ Са3(РО4)2] = [3Х]3  [2Х]2 = 108Х5 = 10-29;
[2Х]2 = 108Х5 = 10-29;
Х= 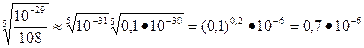 моль.
моль.
Таким образом, в насыщенном растворе [Ca2+]= 3  0,7
0,7  10-6=2,1
10-6=2,1  10-6 моль/л, и [PO43-] = 2
10-6 моль/л, и [PO43-] = 2  0,7
0,7  10-6 = 1,4
10-6 = 1,4  10-6моль/л.
10-6моль/л.
Ответ: [Ca2+]=2,1  10-6 моль/л, [PO43-] =1,4
10-6 моль/л, [PO43-] =1,4  10-6моль/л.
10-6моль/л.
Задача 12. Образуется ли осадок ортофосфата кальция при смешении по одному литру растворов ортофосфата натрия, концентрации 2  10-4 моль/л и хлорида кальция, концентрацией 2
10-4 моль/л и хлорида кальция, концентрацией 2  10-3моль/л.
10-3моль/л.
Решение: При смешении по одному литра двух растворов объем нового раствора удвоится, следовательно концентрации солей в этом растворе уменьшатся в 2 раза. Таким образом, в новом растворе имеем: [Ca2+]= 10-3 моль/л и [PO43-] = 10-4 моль/л.
Произведение ионов в новом растворе будет:
ИП [ Са3(РО4)2] = [Са2+]3  [РО43-]2 = (10-3)3
[РО43-]2 = (10-3)3  (10-4)2= 10-17
(10-4)2= 10-17
Осадок может быт образован при случи, когда ИП по значению оказывается больше, чем ПР. Так как ПР[ Са3(РО4)2] = 10-29, а ИП= 10-17, то осадок выпадет, так как в рассмотренном случае ПИ > ПР.
Ответ: ПИ > ПР, осадок выпадает.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 3547; Нарушение авторских прав?; Мы поможем в написании вашей работы!