
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы
|
|
|
|
Варианты задач по теме 2.1.2
1. Реакция CO + Cl2  COCl2 протекает в объеме 10 литров. Состав равновесной смеси: 14г СО; 35,6г Cl2; и 49,5г СOCl2. Вычислить константу равновесия реакции.
COCl2 протекает в объеме 10 литров. Состав равновесной смеси: 14г СО; 35,6г Cl2; и 49,5г СOCl2. Вычислить константу равновесия реакции.
2. Константа равновесия реакции FeO + CO  Fe + CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и ]CO2] =0,01.
Fe + CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и ]CO2] =0,01.
3. Найти константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляет 0,08моль/л, а к моменту наступления равновесия диссоцировало 50% N2O4.
2NO2, если начальная концентрация N2O4 составляет 0,08моль/л, а к моменту наступления равновесия диссоцировало 50% N2O4.
4. Константа равновесия реакции А+В  С+D равна единице. Начальная концентрация [А]о=0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
С+D равна единице. Начальная концентрация [А]о=0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
5. Для реакции Н2 + Вr2  2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
6. В начальный момент реакции синтез аммиака концентрации были (моль/л):N2 =1,5; H2 =2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
7. Равновесие в системе H2+I2  2HI установилось равновесие при следующих концентрациях (моль/л): [H2] = 0,025; [I2] = 0,005; [HI] = 0,09. Определить исходные концентрации иода и водорода.
2HI установилось равновесие при следующих концентрациях (моль/л): [H2] = 0,025; [I2] = 0,005; [HI] = 0,09. Определить исходные концентрации иода и водорода.
8. При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2  СО + Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
СО + Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
9. Оксид углерода (II) и хлор были помещены в закрытый сосуд при постоянной температуре. Начальные их концентрации равны 1 моль/л, давление в сосуде 101325 Па. В результате реакции CO + Cl2  COCl2 к моменту равновесия осталось 50% СО. Каково давление в сосуде при равновесии?
COCl2 к моменту равновесия осталось 50% СО. Каково давление в сосуде при равновесии?
10. Как изменится давление при наступлении равновесия в реакции синтеза аммиака в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода составляют соответственно 2 и 6 моль/л и если равновесие наступит тогда, когда прореагирует 10% первоначального количества азота?
11. После смешения газов А и В в системе А + В  С + D, устанавливается равновесие при следующих концентрациях (моль/л): [B] = 0,05; [C] = 0,02. Константа равновесия реакции равна 4х103. Найти исходные концентрации А и В.
С + D, устанавливается равновесие при следующих концентрациях (моль/л): [B] = 0,05; [C] = 0,02. Константа равновесия реакции равна 4х103. Найти исходные концентрации А и В.
12. Константа равновесия реакции синтеза этилацетата этерификацией уксусной кислоты в жидкой фазе равна 4. Сколько сложного эфира получится, если в исходной смеси взять 100г этанола и 20г уксусной кислоты.
13. Константа химического равновесия реакции С2H6(г)  С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана-0,07Мпа, этилена-0,02 Мпа и водорода 0,02 МПа.
С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана-0,07Мпа, этилена-0,02 Мпа и водорода 0,02 МПа.
14. Константа химического равновесия реакции С2H6(г)  С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана-0,05Мпа, этилена-0,01 Мпа и водорода 0,02 Мпа
С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана-0,05Мпа, этилена-0,01 Мпа и водорода 0,02 Мпа
15. Константа равновесия реакции FeO + CO  Fe + CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и ]CO2] =0,01.
Fe + CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и ]CO2] =0,01.
16. Найти константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляет 0,08моль/л, а к моменту наступления равновесия диссоцировало 50% N2O4.
2NO2, если начальная концентрация N2O4 составляет 0,08моль/л, а к моменту наступления равновесия диссоцировало 50% N2O4.
17. Константа равновесия реакции А+В  С+D равна единице. Начальная концентрация [А]=0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
С+D равна единице. Начальная концентрация [А]=0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
18. Для реакции Н2 + Вr2  2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
19. В начальный момент реакции синтез аммиака концентрации были (моль/л):N2 =1,5; H2 =2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
20. Равновесие в системе H2+I2  2HI установилось равновесие при следующих концентрациях (моль/л):[H2]=0,025; [I2] =0,005; [HI]=0,09. Определить исходные концентрации иода и водорода.
2HI установилось равновесие при следующих концентрациях (моль/л):[H2]=0,025; [I2] =0,005; [HI]=0,09. Определить исходные концентрации иода и водорода.
21. При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2  СО +Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
СО +Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
22. Как изменится давление при наступлении равновесия в реакции синтеза аммиака в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода составляют соответственно 2 и 6 моль/л и если равновесие наступает тогда, когда прореагирует 10% первоначального количества азота?
23. После смешения газов А и В в системе А + В  С + D, устанавливается равновесие при следующих концентрациях (моль/л): [B]=0,05; [C]=0,02. Константа равновесия реакции равна 4х103. Найти исходные концентрации А и В.
С + D, устанавливается равновесие при следующих концентрациях (моль/л): [B]=0,05; [C]=0,02. Константа равновесия реакции равна 4х103. Найти исходные концентрации А и В.
24. Константа равновесия реакции синтеза этилацетата этерификацией уксусной кислоты в жидкой фазе равна 4. Сколько сложного эфира получится, если в исходной смеси взять 100г этанола и 20г уксусной кислоты.
25. Константа химического равновесия реакции С2H6(г)  С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,07Мпа, этилена-0,02 Мпа и водорода 0,02 МПа.
С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,07Мпа, этилена-0,02 Мпа и водорода 0,02 МПа.
26. Константа химического равновесия реакции С2H6(г)  С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,05Мпа, этилена-0,01 Мпа и водорода 0,02 Мпа
С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,05Мпа, этилена-0,01 Мпа и водорода 0,02 Мпа
27. Константа химического равновесия реакции С2H6(г)  С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,05Мпа, этилена-0,01 Мпа и водорода 0,01 Мпа
С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,05Мпа, этилена-0,01 Мпа и водорода 0,01 Мпа
28. Константа химического равновесия реакции С2H6(г)  С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,06Мпа, этилена-0,02 Мпа и водорода 0,01 МПа
С2Н4(г) + Н2(г) при 1500 К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: Этана-0,06Мпа, этилена-0,02 Мпа и водорода 0,01 МПа
29. Константа равновесия реакции FeO + CO  Fe + CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и [CO2] =0,01.
Fe + CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и [CO2] =0,01.
30. Найти константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляет 0,08моль/л, а к моменту наступления равновесия диссоцировало 50% N2O4.
2NO2, если начальная концентрация N2O4 составляет 0,08моль/л, а к моменту наступления равновесия диссоцировало 50% N2O4.
31. Константа равновесия реакции А+В  С+D равна единице. Начальная концентрация [А]о = 0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
С+D равна единице. Начальная концентрация [А]о = 0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
32. Для реакции Н2 + Вr2  2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
33. В начальный момент реакции синтез аммиака концентрации были (моль/л):N2 =1,5; H2 =2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
34. Равновесие в системе H2+I2 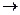 2HI установилось равновесие при следующих концентрациях (моль/л):[H2]=0,025; [I2] =0,005; [HI]=0,09. Определить исходные концентрации иода и водорода.
2HI установилось равновесие при следующих концентрациях (моль/л):[H2]=0,025; [I2] =0,005; [HI]=0,09. Определить исходные концентрации иода и водорода.
35. При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2  СО + Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
СО + Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 1077; Нарушение авторских прав?; Мы поможем в написании вашей работы!