
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворов неэлектролитов
|
|
|
|
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАЗБАВЛЕННЫХ
Вещества, которые в растворе не распадаются на ионы, а существуют в виде сольватированных молекул, называются неэлектролитами.
Разбавленные растворы неэлектролитов, относящихся к нелетучим веществам, обладают рядом коллигативных свойств. Коллигативными свойствами растворов называются такие свойства, которые зависят только от количества растворённых частиц, то есть от концентрации. К таким свойствам относятся:
Понижение давления пара (первый закон Рауля).
Относительное понижение давления насыщенного пара растворителя при образовании раствора равно мольной доле растворенного вещества. Или математически
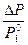 =
= 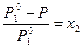 , (13)
, (13)
где Р – давление насыщенного пара над раствором; Р  – давление насыщенного пара чистого растворителя; х 2 – мольная доля растворенного вещества.
– давление насыщенного пара чистого растворителя; х 2 – мольная доля растворенного вещества.
Повышение температуры кипения раствора (второй закон Рауля).
Повышение температуры кипения раствора D T кип прямо пропорционально моляльной концентрации растворенного вещества.
D T кип= T кип – Т 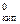 = К Э × Сm, (14)
= К Э × Сm, (14)
где К Э – эбуллиоскопическая константа, 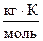 ; Сm - моляльная концентрация, моль/кг; Т
; Сm - моляльная концентрация, моль/кг; Т 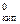 - температура кипения чистого растворителя, К или °С; T кип – температура кипения раствора, К или °С.
- температура кипения чистого растворителя, К или °С; T кип – температура кипения раствора, К или °С.
Понижение температуры замерзания (кристаллизации) раствора.
Понижение температуры замерзания раствора D T зам прямо пропорционально моляльной концентрации растворенного вещества.
D T зам = Т 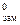 – T зам = К К × Сm, (15)
– T зам = К К × Сm, (15)
где К К – криоскопическая константа, 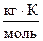 ; Т
; Т 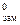 - температура замерзания чистого растворителя, К или °С; T зам – температура замерзания раствора, К или °С.
- температура замерзания чистого растворителя, К или °С; T зам – температура замерзания раствора, К или °С.
Таким образом, раствор кипит при более высокой температуре, чем чистый растворитель, а замерзает при более низкой температуре. Значение эбуллиоскопическойи криоскопической константы зависит только от природы растворителя и приведено в справочной литературе.
По повышению температуры кипения или понижению температуры замерзания раствора можно вычислить молярную массу растворенного вещества
M 2 = К Э×  . (16)
. (16)
M 2 = K К× 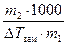 . (17)
. (17)
Осмотическое давление (закон Вант-Гоффа).
Давление, которое нужно приложить к раствору, чтобы остановить одностороннюю диффузию растворителя через полупроницаемую перегородку, называют осмотическим (Р осм). Закон Вант-Гоффа гласит, что осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора
Р осм = С 2 × R × T, (18)
где P осм – осмотическое давление, кПа; С 2 – молярная концентрация вещества, моль/дм3; R = 8,314 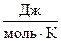 – универсальная газовая постоянная; Т – абсолютная температура, К.
– универсальная газовая постоянная; Т – абсолютная температура, К.
Растворы, обладающие одинаковым осмотическим давлением, называются изотоническими. Раствор, имеющий большее осмотическое давление, является гипертоническим, по отношению к раствору с меньшим значением Р осм, который называют гипотоническим.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 301; Нарушение авторских прав?; Мы поможем в написании вашей работы!