
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы
|
|
|
|
Растворы, содержащие слабый электролит и его соль, способны поддерживать постоянным значение рН раствора. Такие растворы называют буферными. Их можно разделить на два типа: кислотный буфер – состоит из слабой кислоты и её соли; основной буфер – состоит из слабого основания и его соли.
Расчет концентрации ионов Н + в кислотном буфере следует вести по формуле
[Н+] =  , (42)
, (42)
где К Д(кислоты) – константа диссоциации слабой кислоты; [кислоты], [соли] – молярные концентрации кислоты и ее соли, моль/дм3.
Из формулы (42) следует, что
рН = р K Д(кислоты) – lg 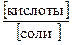 , (43)
, (43)
где р К Д(кислоты) = –lg К Д(кислоты).
По аналогии для буферной смеси слабого основания и его соли
рН = 14 – р K Д(основания) + lg  , (44)
, (44)
где р K Д(основания) = -lg K Д(основания).
Способность буферного раствора поддерживать постоянное значение рН определяется его буферной ёмкостью В, которая характеризуется количеством моль сильной кислоты или сильного основания, которое требуется ввести в 1 дм3 буферного раствора, чтобы изменить его рН на единицу. Буферная ёмкость выражается в моль/дм3 и определяется по формуле
 , (45)
, (45)
где С 2 – молярная концентрация сильной кислоты или основания; V – объём добавленного сильного электролита; VВ – объём буферного раствора; ΔpH – величина изменения рН раствора.
Добавление к буферному раствору кислоты понижает рН раствора, а прибавление щелочи увеличивает рН раствора. Буферная ёмкость раствора тем больше, чем выше концентрация его компонентов.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 244; Нарушение авторских прав?; Мы поможем в написании вашей работы!