
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы сильных электролитов
|
|
|
|
В растворах сильных электролитов в результате их практически полной диссоциации создается высокая концентрация ионов.
Для учета взаимодействия между ионами в растворе сильного электролита введено понятие «активность». Активность – это эффективная концентрация ионов, в соответствии с которой ионы проявляют себя в химических реакциях. Концентрация и активность ионов а связаны соотношением
а = [ион] ×g, (26)
где g– коэффициент активности иона.
В сильно разбавленных растворах сильных электролитов g®1, и следовательно а = [ион].
Активность электролита (Kt) х (Аn) у можно оценить по формуле
а 2 =  , (27)
, (27)
где а ± – средняя ионная активность электролита; g± – средний ионный коэффициент активности; С ± – средняя ионная молярная или моляльная концентрации; n = (х + у) – сумма числа катионов х и числа анионов у, образующихся при диссоциации одной молекулы электролита.
Средняя ионная активность а ± и средний ионный коэффициент активности g± связаны с активностями и коэффициентами активности катионов и анионов соотношениями
а ± =  , (28)
, (28)
g± = 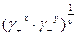 . (29)
. (29)
Среднюю ионную концентрацию электролита следует оценивать по формуле
С ± =  , (30)
, (30)
В разбавленных растворах электролитов средний ионный коэффициент активности можно вычислить по уравнению (предельный закон Дебая-Гюккеля)
lgg± = – 0,5×½  ×
×  ½×
½×  , (31)
, (31)
где  ,
,  – заряды ионов; I – ионная сила раствора.
– заряды ионов; I – ионная сила раствора.
По уравнению Дебая-Гюккеля можно вычислять и коэффициенты активностей отдельных ионов, при этом формула (31) примет вид
lgg+ = – 0,5×½  ½×
½×  , (31 а)
, (31 а)
lgg– = – 0,5×½ 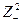 ½×
½× 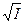 , (31 б)
, (31 б)
Ионной силой раствора I называют полусумму произведения молярных или моляльных концентраций каждого иона на квадрат его заряда
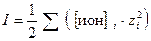 . (32)
. (32)
Наличие взаимодействия между ионами в растворах сильных электролитов приводит к тому, что найденная экспериментально степень диссоциации сильного электролита оказывается несколько меньше 1. Ее называют кажущейся степенью диссоциации и рассчитывают по формуле
a = 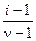 , (33)
, (33)
где i – изотонический коэффициент Вант-Гоффа.
Изотонический коэффициент i показывает, во сколько раз экспериментально найденное свойство раствора электролита отличается от такого же свойства, вычисленного для раствора неэлектролита при той же концентрации:
i =  ,
,
где «свойство раствора» – Р осм, D Р, D Т кип или D Т зам.
Коллигативные свойства для разбавленных растворов электролитов следует оценивать с учетом изотонического коэффициента по формулам
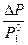 =
= 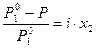 , (34)
, (34)
D T кип= T кип – Т  = i× К Э × Сm, (35)
= i× К Э × Сm, (35)
D T зам = Т  – T зам = i× К К × Сm, (36)
– T зам = i× К К × Сm, (36)
Р осм = i× С 2 × R × T, (37)
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 232; Нарушение авторских прав?; Мы поможем в написании вашей работы!