
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выражение для произведения растворимости имеет вид
|
|
|
|
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Для любого труднорастворимого электролита (Kt) х (Аn) у между его осадком и насыщенным раствором устанавливается равновесие вида
(Kt) х (Аn) у Û x× Kt z+ + y× Аn z–.
осадок насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР.
ПР =  (g + ·[Kt z+ ]) x × (g– ·[Аn z– ]) y, (46)
(g + ·[Kt z+ ]) x × (g– ·[Аn z– ]) y, (46)
где а +, а – – активности катиона и аниона; g + , g– – коэффициенты активностей катиона и аниона; [Kt z+ ], [Аn z– ] – равновесные молярные концентрации ионов, моль/дм3.
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (46) примет вид
ПР = [ Kt z+ ] x × [Аn z– ] y. (47)
ПР электролита при данной температуре есть величина постоянная. Численные значения произведения растворимости большинства труднорастворимых электролитов приведены в справочной литературе.
По величине ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Если произведение концентраций ионов (ПРрасч) в каком-либо растворе соли больше, чем табличное значение ПРтабл, то в растворе будет присутствовать осадок данного вещества. И наоборот, если ПРрасч < ПРтабл, то осадок данного вещества растворится.
Равновесные молярные концентрации ионов [Kt z+ ]и [Аn z– ] пропорциональны растворимости вещества L (моль/дм3)
[Kt z+ ] = x × L; [Аn z– ] = y× L. (48)
Отсюда ПР[(Kt) х (Аn) у ] = (x×L) x × (y× L) y;(49)
L = 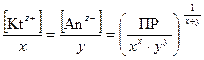 . (50)
. (50)
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 241; Нарушение авторских прав?; Мы поможем в написании вашей работы!