
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
A. Реакции нециклических форм
|
|
|
|
I.8. Химические свойства моносахаридов
Моносахариды – соединения полифункциональные и обладают к тому же строго определенной конфигурацией при нескольких асимметрических атомах углерода. По этой причине необходимо представлять себе пути проведения того или иного превращения строго направленно и с сохранением конфигурации, т.е. регио- и стереоспецифично. Знание этого материала позволит понять, как проводятся синтетические исследования в ряду моносахаридов, приобретающие в последнее время все большее теоретическое и практическое применение.
Углеродная цепь моносахаридов содержит большое число электро-отрицательных групп. Это приводит к уменьшению прочности углерод-углеродных связей, которые оказываются неустойчивыми к действию щелочей и окислителей.
Гидроксильные группы в молекулах моносахаридов обладают значительно более сильными кислотными свойствами, чем в спиртах. Это может объясняться как наличием заместителей, обладающих отрицательным индуктивным эффектом (гидроксильная и карбонильная группы), так и способностью гидроксогрупп стабилизировать соответствующие анионы за счет образования внутримолекулярных водородных связей. Этим объясняется способность моносахаридов образовывать алкоголяты (сахараты) не только со щелочными металлами, но и с их гидроксидами, а также с гидроксидами щелочно-земельных металлов.
Важно отметить, что под действием оснований альдозы и кетозы, являясь по сути альдолями, подвергаются наряду со многими другими превращениями усложнению (конденсации типа альдольной) и деградации (распад типа ретроальдольного) углеродной цепи.
Моносахариды дают реакцию серебряного зеркала при обработке их аммиачным раствором оксида серебра. В случае кетоз это объясняется тем, что в присутствии оснований они способны к изомеризации (эпимеризации), в результате которой генерируется альдегидная форма.
Для качественного обнаружения моносахаридов используют также комплекс меди (II) с винной кислотой, образующийся при взаимодействии последней с сульфатом меди (II) в щелочном растворе. При обработке этим комплексом (так называемый реактив Фелинга) альдоз, а также способных к эпимеризации кетоз выделяется красный осадок оксида меди (I) и образуется сложная смесь продуктов окисления.
В целях селективного окисления альдегидной группы в альдозах может быть использована бромная вода или разбавленная азотная кислота, при этом образуюся альдоновые кислоты:

Окислители со средней окисляющей способностью, например, концентрированная азотная кислота, превращают в карбоксильную группу не только альдегидную, но и первичноспиртовую группы, давая при этом сахарные (альдаровые) кислоты:
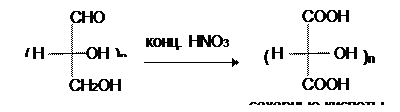
Но, если проводить окисление концентрированной азотной кислотой альдозы с защищенной альдегидной группой, то после снятия защиты можно получить полиоксиальдегидокарбоновые или уроновые кислоты:

Уроновые кислоты образуются в живых организмах при окислении гликозидов и участвуют в процессах детоксикации у теплокровных (например, фенол выводится из организма в виде сложного эфира с глюкуроновой кислотой).
Окисление HJO4, характерное для вицинальных диолов, оксиальдегидов, оксикетонов и приводящее к смеси альдегидов или кислот, для моноз протекает так же и дает смесь формальдегида с муравьиной кислотой:

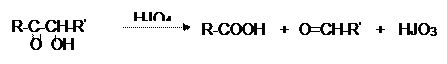
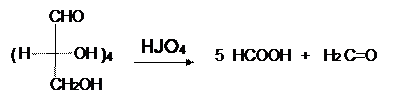
 Моносахариды восстанавливаются в соответствующие полиолы, называемые сахарными спиртами, под действием боргидрида натрия или водородом в присутствии катализаторов (Pt, Pd, Ni):
Моносахариды восстанавливаются в соответствующие полиолы, называемые сахарными спиртами, под действием боргидрида натрия или водородом в присутствии катализаторов (Pt, Pd, Ni):
Из глюкозы получается сорбит (гексит), из маннозы – маннит (гексит), из галактозы – дульцит (гексит), из ксилозы – ксилит (пентит) и т.п.
 |
Ксилоза Ксилит
Следует иметь ввиду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получаются два стереомерных полиола. Так, при восстановлении фруктозы образуются сорбит и маннит.
Ксилит и дульцит используются вместо сахарозы в рационе диабетиков (они обладают сладким вкусом, но не вовлекаются в углеводный обмен и нетоксичны, как сахарин), а сорбит служит исходным веществом в синтезе аскорбиновой кислоты (см. ниже).
Если гидрирование проводить при нагревании, то это приводит к расщеплению углеродной цепи и образованию этиленгликоля, глицерина и других полиолов.
При действии на альдозы бензил- или этилмеркаптанов в кислой среде образуются соответствующие меркаптали (дитиоацетали), устойчивые в нейтральной, щелочной и слабокислой средах:
 |
Получение меркапталей может быть использовано для защиты карбонильной группы при модификации гидроксильной. Тиоацетальные связи легко распадаются под действием брома в разбавленной уксусной кислоте.
Важное значение имеют реакции моносахаридов, в которых затрагивается не только карбонильная группа, но и гидроксил у ближнего атома углерода. К таким реакциям относится взаимодействие моносахаридов с фенилгидразином. Эта реакция протекает по механизму нуклеофильного присоединения по карбонильной группе и приводит к образованию фенилгидразона. При нагревании его с избытком фенилгидразина осуществляется перегруппировка, на первой стадии которой происходит дегидрирование соседней спиртовой группы и одновременно гидрогенолиз фенилгидразинной группировки до анилина и соответствующего имина. Последний, будучи a-иминокарбинольным соединением, реагирует с избытком фенилгидразина с выделением аммиака и воды и образованием бис-фенилгидразона соответствующего a-дикарбонильного соединения. Такие соединения называют озазонами:
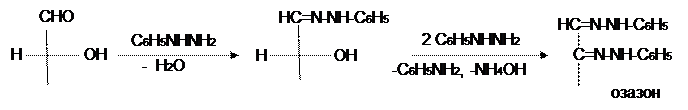
При этом на строение полученного озазона не влияет конфигурация у соседнего с бывшей карбонильной группой асимметрического атома углерода. Поэтому из маннозы и фруктозы можно получить тот же озазон, что и из глюкозы.
Если же полученный озазон подвергнуть кислотному гидролизу, а затем провести мягкое окисление, то из альдозы можно получить кетозу. Так, в промышленности из глюкозы через озазон получают фруктозу:

Кетоальдегид фруктоза
(озон)
Несмотря на большую реакционную способность карбонильной группы в молекуле моносахарида, возможно проведение реакций по первичноспиртовой группе. Так, при обработке трифенилхлорметаном (сокращенно тритилхлоридом) в присутствии пиридина первичные спиртовые группы всех моносахаридов образуют соответствующие трифенилметиловые (тритиловые) эфиры; в мягких условиях другие гидроксильные группы при этом не затрагиваются.
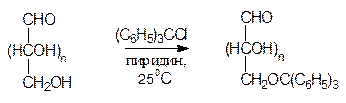
Эта реакция широко используется для защиты первичноспиртовых групп в молекулах моносахаридов при модификациях других фрагментов. Трифенилметильный радикал является хорошей защитной группой, поскольку трифенилметиловые эфиры устойчивы в нейтральной и щелочной средах и легко расщепляются в кислой среде (снятие защиты).
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 508; Нарушение авторских прав?; Мы поможем в написании вашей работы!