
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Знайдіть вираз кінетичного рівняння реакції
|
|
|
|
Тема. Хімічна кінетика. Хімічна рівновага
1. Реакції, які відбуваються в 2-х протилежних напрямах і завершуються встановленням стану хімічної рівноваги:
а) оборотні;
б) необоротні;
в) екзотермічні;
г) ендотермічні.
2. Стан реагуючої системи, при якому швидкості прямої та зворотної реакції однакові:
а) хімічна кінетика;
б) константа рівноваги;
в) хімічна рівновага;
г) зміщення хімічної рівноваги.
3. Кількісною характеристикою стану хімічної рівноваги є:
а) константа швидкості реакції;
б) константа рівноваги;
в) константа прямої реакції;
г) швидкість досягнення рівноваги.
4. Який з факторів не впливає на стан хімічної рівноваги:
а) зміна концентрації;
б) зміна тиску;
в) зміна температури;
г) внесення каталізатора.
5. Константа рівноваги не залежить від:
а) природи реагуючих речовин;
б) температури;
в) зміни концентрації реагуючих речовин;
г) наявності каталізатора.
6. Надлишкова енергія порівняно з середньою енергією реагуючих речовин, яку повинні мати молекули, щоб їх зіткнення призводили до хімічної взаємодії:
а) енергія активації;
б) температурний коефіцієнт реакції;
в) активований комплекс;
г) енергія кристалічної решітки.
7. Система, що утворена активними молекулами, де одночасно відбувається розрив старих хімічних зв’язків і утворення нових:
а) каталізатор;
б) кінцевий стан;
в) субстрат;
г) активований комплекс.
СО + Н2О → 2NO2 + H2
а) υ = κ ∙ С2(СО)∙С2(Н2О);
б) υ = κ ∙ С2(NО2)∙С2(Н2);
в) υ = κ ∙ С2(NО2)∙С(Н2);
г) υ = κ ∙ С(СО)∙С(Н2О).
9. Швидкість гетерогенної реакції залежить від:
а) температури;
б) концентрації рідкої або газоподібної речовини;
в) величини поверхні твердої речовини, дифузії;
|
|
|
г) концентрації твердої речовини, наявності каталізатора,
температури.
10. За хімічною будовою ферменти поділяють на:
а) апоферменти, коферменти, кофактори;
б) ферменти – протеїни, ферменти – протеїди;
в) перехідні метали, напівпровідникові оксиди, ізолятори, кислотні каталізатори;
г)гомогенні, гетерогенні, біологічні.
11. Константа швидкості реакції не залежить від:
а) природи реагентів;
б) концентрації реагентів;
в) температури;
г) наявності каталізаторів.
12. Число молекул, які беруть участь в елементарному акті взаємодії:
а) молекулярність реакції;
б) порядок реакції;
в) константа швидкості реакції;
г) кількість речовин.
13. Сума показників степенів при концентраціях у кінетичному рівнянні реакції:
а) порядок реакції за окремим реагентом;
б) молекулярність реакції;
в) порядок реакції;
г) стехіометричні коефіцієнти.
14. Залежність швидкості реакції від температури визначається:
а) законом діючих мас;
б) ІІ законом термодинаміки;
в) принципом Ле Шательє;
г) рівнянням Арреніуса, правилом Вант-Гоффа.
15. Різниця між енергією активованого комплексу та середньою енергією реагентів:
а) тепловий ефект реакції;
б) енергія активації;
в) середня енергія продуктів;
г) середня енергія реагентів.
16. Ферменти як каталізатори характеризуються:
а) специфічністю;
б) утворенням проміжних сполук;
в) високою специфічністю, каталітичною дією, чутливістю до реакції середовища, температури;
г) агрегатним станом, утворенням активних комплексів, високими значеннями енергії активації.
17. Значення константи рівноваги не залежить від:
а) концентрації, температури, тиску, каталізатору, енергії активації;
б) температури, від природи реагуючих речовин, тиску;
в) концентрації реагуючих речовин, природи реагуючих речовин;
г) концентрації, тиску, каталізатору, енергії активації.
18. Перехід системи від одного стану рівноваги до іншого:
|
|
|
а) зміщення хімічної рівноваги;
б) перебіг реакції в прямому напрямі;
в) перебіг реакції в зворотному напрямі;
г) встановлення рівноваги.
19. Знайдіть вираз кінетичного рівняння реакції:
СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О
а) υ= κ∙ С(СН3СООН)∙С(С2Н5ОН);
б) υ= κ∙ С(СН3СООС2Н5)∙С(Н2О);
в) υ= κ∙ С(СН3СООН);
г) Крівн =  .
.
20. Кожна хімічна реакція відбувається через утворення активованого комплексу, який потім розпадається на продукти даної реакції – це сутність:
а) теорії перехідного стану;
б) теорії зіткнень;
в) теорії проміжних сполук;
г) адсорбційної теорії.
21. Речовина, що підсилює ефективність дії каталізатора:
а) каталізатор;
б) субстрат; фермент;
в) інгібітор;
г) промотор.
22. Каталіз буває:
а) позитивний, негативний;
б) гомогенний, автокаталіз, ферментативний;
в) гомогенний, гетерогенний;
г) позитивний, ферментативний, адсорбційний.
23. Механізм дії ферментів у процесах каталізу:
а) утворення активних центрів;
б) утворення фермент-субстратних комплексів;
в) утворення міцних комплексів, поступове зв’язування і вилучення ферменту;
г) утворення активованих комплексів, супроводжуються розривом і утворенням ковалентних зв’язків, відокремлення продуктів реакції від ферменту.
24. З підвищенням енергії активації:
а) знижується число активних молекул, ефективних зіткнень, швидкість реакції;
б) зростає число активних молекул, ефективних зіткнень, швидкість реакції;
в) знижується температура;
г) збільшується константа швидкості реакції.
25. Швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, які взяті у степенях із стехіометричними коефіцієнтами:
а) закон дії мас;
б) правило Вант-Гоффа;
в) принцип рухомої рівноваги;
г) закон Гесса.
26. Виберіть вираз правила Вант – Гоффа:
а) Nакт = N0 ∙e –E/RT;
б) υ2 = 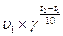 ;
;
в) υ= κ∙ Са (А) ∙ Св(В);
г) Ln k = Ln A – Ea/RT.
27. Гетерогенний каталіз відбувається:
а) каталізатор і реагуюча система знаходяться в однаковому агрегатному стані;
б) в біологічних системах;
в) каталізатор і реагуюча система знаходяться в різних фазових станах;
г) на поверхні фазового розділу.
28. В якому напрямі зміститься рівновага в реакції гідролізу
|
|
|
NaHCO3 + H2O → NaOH + H2CO3
при розведенні водою і при додаванні оцтової кислоти:
а) вправо (в бік прямої реакції);
б) вліво (в бік зворотної реакції);
в) при розведенні водою ‑ вправо, при додаванні оцтової кислоти ‑ вліво;
г) при розведенні водою ‑ вліво, при додаванні оцтової кислоти – вправо.
29. Константа швидкості реакції не залежить від:
а) природи реагентів;
б) концентрації реагентів;
в) температури;
г) наявності каталізаторів.
30. Які ствердження не є положеннями теорії зіткнень:
а) молекули газу повинні зіткнутись, щоб прореагувати;
б) швидкість реакції менша частоти зіткнень;
в) у взаємодію вступають тільки активні молекули;
г) з підвищенням температури на кожні 100 швидкість гомогенних реакцій зростає в 2-4 рази;
д) під час зіткнення частинки повинні бути певним чином орієнтовані.
31. Кількісною характеристикою стану хімічної рівноваги є:
а) константа швидкості реакції;
б) константа рівноваги;
в) константа прямої реакції;
г) швидкість досягнення рівноваги.
32. Механізм дії ферментів у процесах каталізу:
а) утворення активних центрів;
б) утворення фермент-субстратних комплексів;
в) утворення міцних комплексів, поступове зв’язування і вилучення ферменту;
г) утворення активованих комплексів, супроводжуються розривом і утворенням ковалентних зв’язків відокремлення продуктів реакції від ферменту.
33. Залежність швидкості реакції від температури визначається:
а) законом діючих мас;
б) ІІ законом термодинаміки;
в) принципом Ле Шательє;
г) рівнянням Арреніуса, правилом Вант-Гоффа.
34. Реакції, які відбуваються в 2-х протилежних напрямах і завершуються встановленням стану хімічної рівноваги:
а) оборотні;
б) необоротні;
в) екзотермічні;
г) ендотермічні.
35. Константа швидкості реакції не залежить від:
а) природи реагентів;
б) концентрації реагентів;
в) температури;
г) наявності каталізаторів.
36. Виберіть ствердження, що не відповідають механізму дії позитивних каталізаторів:
а) утворення проміжних сполук (інтермедіатів);
б) запобігання звичайному шляху перебігу реакції, вступаючи в реакцію з окремими проміжними сполуками, видаляючи їх з реакційної суміші;
|
|
|
в) зниження енергії активації;
г) збільшення частоти ефективних зіткнень.
37. Ферменти – протеїди складаються:
а) тільки з поліпептидних ланцюгів;
б) з білкової частини (апофермент) і небілкового компоненту (кофермент);
в) з апоферменту, що зумовлює специфічність взаємодії між ферментом і субстратом;
г) з кофактору, який підвищує стійкість білкової частини, може каталізувати інші процеси.
38. В якому напрямі зміститься рівновага в реакції гідролізу FeCl3 + H2O → FeOHCl2 + HCl
при розведенні водою, при додаванні лугу:
а) вправо (в бік прямої реакції);
б) вліво (в бік зворотної реакції);
в) при розведенні водою – вправо, при додаванні лугу – вліво;
г) при розведенні водою – вліво, при додаванні лугу – вправо.
39. Речовина, що прискорює швидкість реакції, бере участь у її проміжних стадіях, але кількісно і якісно при цьому не змінюється:
а) активований комплекс;
б) інгібітор;
в) каталізатор;
г) промотор.
40. Виберіть вираз константи дисоціації оцтової кислоти:
а) Кд = 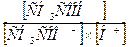 ;
;
б) Кд = 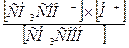 ;
;
в) υ = κ∙ С(СН3СООН);
г) Кд = 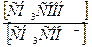 .
.
41. Каталіз реакції одним з її продуктів називається:
а) позитивний каталіз;
б) гомогенний каталіз;
в) автокаталіз;
г) гетерогенний каталіз.
42. Залежність швидкості реакції від концентрації реагуючих речовин визначається:
а) законом дії мас;
б) ІІ законом термодинаміки;
в) принципом Ле Шательє;
г) рівнянням Арреніуса, правилом Вант-Гоффа.
43. Відношення добутку концентрацій продуктів реакції до добутку концентрацій вихідних речовин після досягнення системою стану рівноваги:
а) константа швидкості реакції;
б) константа рівноваги;
в) ступінь дисоціації;
г) швидкість хімічних реакцій.
44. З підвищенням енергії активації:
а) знижується число активних молекул, ефективних зіткнень, швидкість реакції;
б) зростає число активних молекул, ефективних зіткнень, швидкість реакції;
в) знижується температура;
г) збільшується константа швидкості реакції.
45. Сума показників степенів при концентраціях у кінетичному рівнянні реакції:
а) порядок реакції за окремим реагентом;
б) молекулярність реакції;
в) порядок реакції;
г) стехіометричні коефіцієнти.
46. Основна роль каталізатора:
а) утворення з реагентом проміжних реакційно здатних сполук, які легко розкладаються на продукти реакції;
б) не впливає на загальну стехіометрію реакції;
в) прискорює перебіг реакції, створюючи умови для нового шляху реакції, сприяє упорядкуванню реагентів в активованому комплексі;
г) приймає хімічну участь в реакції: витрачається на одній стадії та регенерується на іншій.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 425; Нарушение авторских прав?; Мы поможем в написании вашей работы!