
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Які ствердження вірні?
|
|
|
|
а) ентропія з підвищенням температури збільшується;
б) ентропія зменшується під час переходу речовини з кристалічного стану в рідкий;
в) ентропія збільшується при переході речовини з рідкого стану у газоподібний;
г) ентропія не залежить від температури.
24. Якщо реакція відбувається за постійного тиску, то теплота, що поглинається системою використовується на.................. Це формулювання................ Вкажіть математичний вираз цього закону:
а) ∆U = Q + A;
б) Qp = ∆H = H2 – H1;
в) ∆G = ∆H – T∆S;
г) ∆H = H2 – H1.
25. Знайдіть вираз наслідку із закону Гесса для реакції:
С2Н5ОН + 3О2 → 2СО2 + 3Н2О
а) ∆Н = ∆Ноутв.СО2 + ∆Ноутв.Н2О - ∆Ноутв.С2Н5ОН;
б) ∆Н = ∆Ноутв.С2Н5ОН + 3∆Ноутв.О2 - 2∆Ноутв.СО2 - 3∆Ноутв.Н2О;
в) ∆Н = 2∆Ноутв.СО2 + 3∆Ноутв.Н2О - ∆Ноутв.С2Н5ОН;
г) ∆Н = 2∆Ноутв.СО2 + 3∆Ноутв.Н2О - ∆Ноутв.С2Н5ОН - 3∆Ноутв.О2.
26. Назвіть кількість фаз і компонентів в системі: водний розчин солі:
а) 1 фаза, 2 компоненти;
б) гомогенна система, 1 компонент;
в) 2 фази, 2 компоненти;
г) 2 фази, 1 компонента.
27. Які процеси супроводжуються зростанням ентропії:
а) нагрівання, охолодження, плавлення, твердіння;
б) кристалізація, твердіння, реакція полімеризації;
в) із зростанням упорядкованості в системі;
г) плавлення, випаровування, сублімація, розширення газів.
28. Мірою зв’язаною енергії є:
а) ентальпія;
б) вільна енергія;
в) ентропія;
г) енергія Гіббса.
29. В ізольованій системі спонтанні процеси відбуваються у напрямі збільшення:
а) ентропії;
б) ентальпії;
в) ізобарно-ізотермічного потенціалу;
г) температури.
30. Експериментальна методика, яка використовується для визначення ентальпії, називається:
а) калориметрія;
б) термохімія;
в) термодинаміка;
г) візуальна колориметрія.
31. Ентальпія характеризує................ Позначається.......... Одиниці вимірювання................... Яка залежність існує між ентальпією та внутрішньою енергією системи: запишіть математичний вираз.
а) тепловміст системи, S, Дж/моль 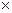 град;
град;
б) тепловміст системи, Н, Дж/моль;
в) хаотичність в системі, Н, Дж/моль 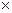 град;
град;
г) хаотичність в системі, S, Дж/моль 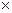 град.
град.
32. Хімічний процес, що відбувається за Р=cоnst супроводжується зміною об’єму газоподібних речовин, причому 1) об’єм продуктів більший, ніж об’єм реагентів; 2) об’єм реагентів перевищує об’єм продуктів. Вкажіть, в якому випадку здійснена механічна робота буде мати значення:
а) у першому випадку ∆V>0, тому А<0;
б) у першому випадку ∆V<0, тому А>0;
в) у другому випадку ∆V>0, тому А<0;
г) у другому випадку ∆V<0, тому А>0;
33. За яких умов відповідно до ІІ закону термодинаміки відбуватиметься самодовільний процес:
а) ∆G>O;
б) ∆G<O: ∆H↓, T∆S↑;
в) ∆H=O, ∆S>O;
г) ∆H>O, ∆S<O, ∆U >O.
34. Склад термодинамічної системи характеризується таким чином: можлива тільки теплопередача у зовнішнє середовище. Назвіть вид системи:
а) відкрита;
б) закрита;
в) ізольована;
г) закрита, в якій відбувається теплопередача.
35. Знайдіть вираз наслідку із закону Гесса:
2ZnS + 3O2 → 2ZnO + 2SO2
а) 2∆Н = 2∆Ноутв.ZnO + 2∆Ноутв.SO2 -2 ∆Ноутв.ZnS – 3∆Ноутв.O2;
б) ∆Н = 2∆Ноутв.ZnO + 2∆Ноутв.SO2 - ∆Ноутв.ZnS – 3∆Ноутв.O2;
в) ∆Н = 2∆Ноутв.ZnO + 2∆Ноутв.SO2 - ∆Ноутв.ZnS;
г) ∆Н = 2∆Ноутв.ZnS + 3∆Ноутв.O2 - 2∆Ноутв.ZnO - 2∆Ноутв.SO2.
36. Назвіть кількість фаз і компонентів в системі: вода – олія:
а) 1 фаза, 1 компонента;
б) 1 фаза, 2 компоненти;
в) 2 фази, 1 компонента;
г) 2 фази, 2 компоненти.
37. Виберіть гетерогенні системи:
а) розчин цукру у воді;
б) вода – бензол;
в) повітря;
г) лід – вода, завис спецій у воді.
38. Яка з наведених величин не є функцією стану системи:
а) ентальпія, ентропія;
б) теплота;
в) внутрішня енергія;
г) температура.
39. Енергія ізольованої системи стала і зберігається за будь-яких змін. Це формулювання:
а) І закону термодинаміки;
б) ІІ закону термодинаміки;
в) ІІІ закону термодинаміки;
г) закону Гесса.
40. Некорисна частина внутрішньої енергії, яка не перетворюється на роботу називається............ Позначається.................. Мірою зв’язаної енергії є............
а) вільна енергія, G, ентропія;
б) зв’язана енергія, F, ентальпія;
в) вільна енергія, F, ентропія;
г) зв’язана енергія, F, ентропія.
41. Тепловий ефект реакції дорівнює сумі ентальпій........................ Позначається................ Вимірюється..................
а) продуктів реакції мінус суму ентальпій вихідних речовин, ∆Н, Дж (до 1молю речовини);
б) продуктів реакції, ∆Н, Дж (моль 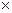 град);
град);
в) вихідних речовин мінус суму ентальпій продуктів реакції, ∆Н, Дж;
г) продуктів реакції і вихідних речовин, ∆S, Дж/моль 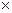 град).
град).
42. Ентальпії реагентів менші, ніж значення ентальпій продуктів реакції, теплота........, реакція є....................
а) поглинається, ендотермічна;
б) виділяється, екзотермічна;
в) поглинається, екзотермічна реакція;
г) ∆Н1 < ∆Н2, ∆Н >0.
43. Знайдіть вираз І закону термодинаміки для ізохорного процесу:
а) ∆U = Q + A;
б) ∆U = QV;
в) ∆Hoутв. = -∆Нрозкл.;
г) ∆G = ∆H – T∆S.
44. Які фактори свідчать про самодовільність і необоротність хімічного процесу:
а) зменшення значення ізобарно-ізотермічного потенціалу;
б) збільшення ентропії в екзотермічних реакціях;
в) збільшення ентропії в реакціях, які відбуваються без зміни ∆Н;
г) зменшення ентропії в ендотермічних реакціях;
д) збільшення значення ізобарно-ізотермічного потенціалу.
45. Знайдіть вираз наслідку із закону Гесса для реакції:
Al2O3 + 2Cr → Cr2O3 + 2Al
а) ∆H = ∆Ноутв.Cr2O3 + 2∆Ноутв.Al - ∆НоутвAl2O3 + ∆НоутвCr;
б) ∆H = ∆НоутвAl2O3 + 2∆НоутвCr - ∆Ноутв.Cr2O3 - 2∆Ноутв.Al;
в) ∆H = ∆НоутвCr2O3 - ∆НоутвAl2O3;
г) ∆H = ∆НоутвAl2O3 - ∆НоутвCr2O3.
46. В якій системі відбувається лише обмін енергією з оточенням:
а) термодинамічна система;
б) відкрита система;
в) закрита система;
г) ізольована система.
47. В ендотермічній реакції:
а) ентальпії продуктів менші ентальпії реагентів;
б) теплота передається оточенню;
в) ентальпії продуктів більші ентальпії реагентів;
г) тепловий ефект має позитивне значення.
48. Сукупність усіх частин термодинамічної системи з однаковими властивостями, які відокремлені від інших частин поверхнею розділу:
а) фаза;
б) компонента;
в) міжфазова поверхня;
г) гомогенна система.
49. Перетворення речовин бувають:
а) фізичні;
б) хімічні;
в) фазові, хімічні;
г) фізичні, хімічні, фізико-хімічні.
50. Ізохорні процеси відбуваються за:
а) постійного тиску;
б) постійній температурі;
в) постійній температурі та постійному об’ємі;
г) постійного об’єму.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 389; Нарушение авторских прав?; Мы поможем в написании вашей работы!