
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виберіть вираз кінетичного рівняння реакції
|
|
|
|
S + H2 → H2S:
а) υ = κ∙  ;
;
б) υ = κ 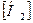 ;
;
в) 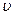 = κ
= κ 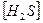 ;
;
г) Кд = 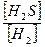 .
.
48. В якому напрямі зміститься рівновага в реакції гідролізу
(NH4)2CO3 + H2O → NH4OH + NH4 HCO3
при розведенні водою і при додаванні оцтової кислоти:
а) вправо (в бік прямої реакції);
б) вліво (в бік зворотної реакції);
в) при розведенні водою – вправо, при додаванні оцтової кислоти – вліво;
г) при розведенні водою – вліво, при додаванні оцтової кислоти – вправо.
49. Гомогенний каталіз відбувається:
а) каталізатор і реагуюча система знаходяться в однаковому фазовому стані;
б) каталізатор і реагуюча система знаходяться в різних фазових станах;
в) на поверхні фазового розділу;
г) в біологічних системах за участю ферментів.
50. Зміна концентрації реагуючих речовин або кінцевих продуктів:
а) константа швидкості реакції;
б) константа рівноваги;
в) швидкість реакції;
г) хімічна рівновага.
Тема. Істинні розчини
- Гомогенні термодинамічно стійкі рівноважні системи змінного складу з 2-х і більше компонентів:
а) дисперсні системи;
б) грубодисперсні системи;
в) колоїдні розчини;
г) істинні розчини.
- За концентрацією розчинених речовин рідкі розчини поділяють:
а) водні та неводні розчини;
б) розчини електролітів і неелектролітів;
в) насичені, ненасичені й пересичені розчини;
г) розбавлені й концентровані розчини.
- На розчинність твердих речовин в рідинах не впливає:
а) тиск;
б) природа розчинника і розчиненої речовини;
в) температура;
г) площа поверхні стикання.
- Яка існує залежність між розчинністю газу та парціальним тиском:
а) вагова кількість газу, розчиненого в даному об’ємі рідини, прямо пропорційна тиску газу (закон Генрі);
б) чим більший тиск, під яким перебуває газ, тим менша його розчинність;
в) при збільшенні парціального тиску над розчином, зменшується розчинність газу в рідині;
г) при зменшенні парціального тиску над розчином, зменшується розчинність газу в рідині.
- Як збільшити розчинність хлориду натрію у воді:
а) подрібненням;
б) перемішуванням;
в) зниженням температури;
г) збільшенням температури (розчинення хлориду натрію – ендотермічний процес).
- Знайдіть вираз І закону Рауля:
а) Р = 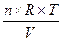 ;
;
б) Ра= Р  ;
;
в) 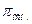 =
=  ;
;
г) 
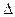
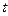
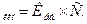
- Активну кислотність визначають:
а) титруванням;
б) вимірюванням рН розчинів;
в) за формулою: рН= -lg [H+] для розчинів сильних електролітів.
- Від якого фактору не залежить швидкість дифузії:
а) ступеня невирівненості концентрації;
б) температури, розмірів частинок дисперсної фази;
в) в’язкості середовища;
г) рН середовища.
- Яким методом не визначають рН розчинів:
а) індикаторним;
б) титруванням;
в) приладом Міхаеліса;
г) рН – метром.
- Виберіть вірні ствердження:
а) тиск насиченої пари розчинника над розчином менше тиску насиченої пари розчинника над чистим розчинником;
б) зниження тиску пари над розчином більше, чим вища концентрація розчиненої речовини у розчині;
в) тиск насиченої пари розчинника над розчином більше тиску насиченої пари розчинника над чистим розчинником;
г) зниження тиску пари над розчином менше. чим вища концентрація розчиненої речовини.
- Розчинність газів в рідинах зростає при:
а) підвищенні температури та тиску;
б) підвищенні тиску, зниженні температури;
в) зниженні тиску, зниженні температури;
г) зниженні тиску, підвищенні температури, наявності електроліту.
- Відношення відповідних експериментальних значень величин зниження тиску пари, зміни температури кипіння та замерзання, осмотичного тиску до теоретично обчислених:
а) ізотонічний коефіцієнт;
б) константа дисоціації;
в) уявний ступінь дисоціації;
г) кріоскопічна константа.
- Назвіть рідини, що необмежено розчиняються одна в одній:
а) анілін – вода;
б) спирт – вода;
в) бензол – вода;
г) хлороформ – вода.
- Дифузія збільшується при:
а) збільшенні температури, розміру частинок, зменшенні в’язкості середовища;
б) збільшенні температури, зменшенні в’язкості середовища та розміру частинок;
в) зниженні температури, зменшення в’язкості та розміру частинок;
г) підвищенні температури, збільшенні розміру частинок та в’язкості середовища.
- Плазмоліз відбувається, якщо:
а) π осм зовнішнього розчину більший за тиск в клітині;
б) πосм зовнішнього розчину менший за тиск в клітині;
в) πосм зовнішнього розчину однаковий з тиском;
г) Р зовнішній більший за πосм
- Виберіть процеси, що базуються на явищі екстракції:
а) освітлення бульйону за допомогою відтяжки;
б) витягання цукру з цукрового буряка;
в) пасерування моркви;
г) розділення водно-спиртової суміші при виготовленні спиртних напоїв.
- Знайдіть вираз закону Вант – Гоффа для розчинів неелектролітів:
а) Ра= Р  ;
;
б) 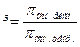 ;
;
в) 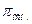 =
=  ;
;
г) Р = 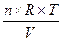 .
.
- Ступінь дисоціації дуже слабкого електроліту можна обчислити за формулою:
а) 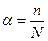 ;
;
б) 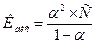 ;
;
в) 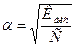 ;
;
г) 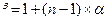 .
.
- Кількість газу, що розчиняється за сталої температури у певному об’ємі розчинника, пропорційна його тискові:
а) закон Генрі;
б) І закон Рауля;
в) закон Вант – Гоффа;
г) ІІ закон Рауля.
- Довільний перехід розчинника через напівпроникну мембрану з розбавленого розчину в концентрований розчин:
а) дифузія;
б) осмос;
в) плазмоліз;
г) тиск пари над розчином.
- Тиск, який необхідно прикласти до концентрованого розчину, щоб завадити перенесенню розчинника через мембрану:
а) осмотичний тиск;
б) парціальний тиск;
в) тиск насиченої пари;
г) тиск газу.
- Залежність тиску пари від концентрації розчину встановлює:
а) закон Вант - Гоффа;
б) І закон Рауля;
в) ІІ закон Рауля;
г) рівняння стану ідеального газу.
- Внаслідок збільшення концентрації розчиненої речовини:
а) температура кипіння розчину збільшується;
б) температура замерзання розчину збільшується;
в) температура кипіння розчину знижується;
г) температура замерзання розчину знижується.
- Концентрація вільних гідратованих іонів водню:
а) загальна кислотність;
б) активна кислотність;
в) водневий показник;
г) молярна концентрація.
- Для точного визначення рН різних розчинів користуються:
а) індикаторами;
б) буферними розчинами;
в) електрохімічним методом;
г) приладом Міхаеліса.
- З переліку систем виберіть рідини, що практично не розчиняються одна в одній:
а) хлороформ + бензол;
б) вода + толуол;
в) фенол + вода;
г) ефір + вода.
- Чим пояснити той факт, що при додаванні цукру до газованої води спостерігається виділення бульбашок газу:
а) зменшення розчинності СО2 у газованій воді при додаванні цукру;
б) зменшення розчинності СО2 у газованій воді пояснюється зменшенням тиску газу над розчином;
в) розчинність газу зменшується при наявності третього компоненту;
г) наявність електроліту не впливає на розчинність СО2 у воді.
- Пересичений розчин характеризується:
а) рівновагою між швидкістю розчинення речовини та швидкістю кристалізації;
б) концентрація речовини в розчині більша за розчинність;
в) малою кількістю розчиненої речовини;
г) швидкість розчинення менша за швидкість кристалізації.
- При розчиненні твердої речовини спостерігається охолодження розчину:
а) теплота розчинення має додатне значення;
б) теплота розчинення має від’ємне значення;
в) руйнування кристалічної решітки речовини потребує більше теплоти, ніж виділяється в результаті гідратації;
г) руйнування кристалічної решітки речовини потребує менше теплоти, ніж виділяється в результаті гідратації.
- Тиск насиченої пари розчинника над розчином прямо пропорційний молярній долі розчинника:
а) закон Генрі;
б) закон Вант – Гоффа;
в) І закон Рауля;
г) ІІ закон Рауля.
- Суміші концентрованих розчинів слабкої кислоти або основи та її солі, що утворена сильною основою (кислотою):
а) істинні розчини;
б) розчини електролітів;
в) буферні розчини;
г) водні розчини індикаторів.
- Зв’язок між константою і ступенем дисоціації встановлює:
а) закон Вант – Гоффа для сильних електролітів;
б) ІІ закон Рауля;
в) ізотонічний коефіцієнт;
г) закон розведення Оствальда.
- Відношення числа частинок електроліту, що розпалися на іони до загального числа його частинок у розчині:
а) ступінь дисоціації;
б) уявний ступінь дисоціації;
в) константа дисоціації;
г) ізотонічний коефіцієнт.
- Константа дисоціації не залежить від:
а) концентрації електроліту в розчині;
б) температури;
в) природи електроліту;
г) природи розчинника.
- Загальна кислотність визначається:
а) вимірюванням рН;
б) індикаторами;
в) титруванням;
г) титруванням та електрохімічним методом.
- Тургор відбувається, якщо:
а) πосм зовнішнього розчину більший за тиск в клітині;
б) πосм зовнішнього розчину менший за тиск в клітині;
в) πосм зовнішнього розчину однаковий з тиском в клітині;
г) Р зовнішній більший за πосм
- До колігативних властивостей розчинів належать:
а) осмотичний тиск;
б) розчинення;
в) підвищення температури кипіння розчинів;
г) іонний добуток води.
- Яким чином змінюється розчинність газів із зміною температури:
а) зі збільшенням температури розчинність газів збільшується;
б) зі збільшенням температури розчинність газів зменшується;
в) зі зменшенням температури розчинність газів зменшується;
г) зміна температури не впливає на розчинність газів.
- Насичений розчин характеризується:
а) малою кількістю розчиненої речовини;
б) може бути неконцентрованим, і навпаки, може бути дуже розведеним, якщо речовина погано розчиняється;
в) речовина навіть при тривалому збовтуванні більше не розчиняється при даній температурі;
г) знаходиться в стані рівноваги, коли швидкість розчинення речовини дорівнює швидкості кристалізації.
- Розчини, утворення яких з компонентів не супроводжується зміною об’єму системи, тепловими ефектами:
а) розведені;
б) ідеальні;
в) розчини електролітів;
г) концентровані.
- Якщо при розчиненні твердої речовини у воді спостерігається розігрівання розчину:
а) руйнування кристалічної решітки речовини потребує більше теплоти, ніж виділяється в результаті гідратації;
б) руйнування кристалічної решітки речовини потребує менше теплоти, ніж виділяється в результаті гідратації;
в) теплота розчинення має позитивне значення;
г) руйнування кристалічної решітки речовини потребує приблизно стільки ж теплоти, скільки виділяється в результаті гідратації.
- З переліку систем виберіть рідини, що обмежено розчиняються одна в одній:
а) фенол + вода;
б) анілін + вода;
в) хлороформ + вода;
г) ефір + вода.
- Чим можна пояснити той факт, що при різкому відкриванні пляшки з газованим напоєм спостерігаємо виділення бульбашок газу:
а) зменшується розчинність газу;
б) збільшується розчинність газу;
в) зниження парціального тиску газу над розчином приводить до зменшення розчинності газу та видаленню його з рідини у вигляді бульбашок;
г) парціальний тиск газу над розчином різко збільшується, що призводить до збільшення розчинності газу.
- Ненасичений розчин характеризується:
а) речовина навіть при тривалому збовтуванні більше не розчиняється при даній температурі;
б) концентрація завжди менша за концентрацію насиченого розчину;
в) концентрація речовини в розчині більша ніж розчинність;
г) швидкість розчинення більша ніж швидкість кристалізації.
- Яким чином залежить розчинність твердих речовин від температури:
а) якщо теплота розчинення має позитивне значення, то збільшення температури збільшує розчинність твердої речовини;
б) з підвищенням температури обов’язково зростає розчинність твердої речовини;
в) якщо розчинення твердої речовини супроводжується виділенням теплоти, то підвищення температури сприяє розчиненню.
г) якщо розчинення твердої речовини супроводжується поглинанням теплоти, то підвищення температури сприяє розчиненню.
- Кількість речовини, що перенесена за одиницю часу через одиницю площі поверхні:
а) швидкість реакції;
б) коефіцієнт дифузії;
в) моль;
г) швидкість дифузії.
- Самочинний перехід розчинника через напівпроникну мембрану з розбавленого розчину в концентрований розчин:
а) дифузія;
б) осмос;
в) плазмоліз;
г) тиск пари над розчином.
- Знайдіть вираз ІІ закону Рауля:
а) Ра= Р  ;
;
б) 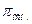 =
=  ;
;
в) 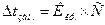 ;
;
г) 
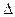
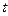
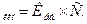
- Зв’язок між ступенем дисоціації електроліту та його константою дисоціації встановлює:
а) закон Вант – Гоффа;
б) закон розведення Оствальда;
в) І закон Рауля;
г) ІІ закон Рауля.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 304; Нарушение авторских прав?; Мы поможем в написании вашей работы!