
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ТЕМА 8. Кислородсодержащие органические соединения
|
|
|
|
Основные вопросы
Спирты и фенолы. Классификация, изомерия, номенклатура. Электронное строение гидроксильной группы. Водородные связи, кислотность и основность. Влияние на физические свойства. Реакции нуклеофильного замещения гидроксильной группы, роль кислотного катализа, понятие о реакциях элиминирования и окисления. Окисление первичных, вторичных и третичных спиртов. Дегидратация спиртов (внутри- и межмолекулярная). Представители многоатомных спиртов и фенолов (этиленгликоль, глицерин, ксилит, сорбит, гидрохинон). Понятие о простых эфирах.
Альдегиды и кетоны. Классификация, изомерия, номенклатура. Электронное строение карбонильной группы. Реакции нуклеофильного присоединения (гидратация, образование полуацеталей и ацеталей, присоединение синильной кислоты и бисульфитов). Нуклеофильное присоединение с отщеплением, образование иминов (оснований Шиффа), оксимов, гидразонов. Окислительно-восстановительные реакции.
Карбоновые кислоты и их производные. Классификация, изомерия и номенклатура. Электронное строение карбоксильной группы. Кислотность и основность. Функциональные производные карбоновых кислот: ангидриды, галогенангидриды, амиды, сложные эфиры. Механизмы реакций этерификации, гидролиза и омыления.
Сложные эфиры одноосновных и многоосновных карбоновых кислот. Номенклатура. Жиры и мыла. Состав и строение. Твердые и жидкие жиры. Высыхающие и невысыхающие масла. Реакции, характеризующие непредельность жиров. Гидрогенизация жиров. Пищевое и промышленное значение жиров. Промышленные полиэфиры (лавсан).
Гидроксикарбоновые кислоты. Гликолевая, молочная, винная, яблочная, лимонная, изолимонная кислоты. Стереохимиягидроксикислот.
Методические указания
Начните изучение темы с простейших кислородсодержащих органических соединений – спиртов и фенолов.
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп -ОН, связанных с углеводородным радикалом. В зависимости от характера углеводородного радикала спирты бывают алифатические, циклические и ароматические, причем у последних гидроксильная группа не связана с атомом углерода бензольного кольца. Соединения, у которых гидроксильная группа непосредственно связана с бензольным кольцом называют фенолами.
Обратите внимание на то, что в зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трехатомные. Спирты, содержащие несколько групп -ОН, объединяют одним названием многоатомные спирты. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные, вторичные и третичные.
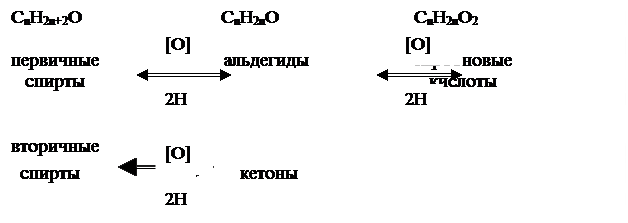 Положение спиртов в ряду кислородсодержащих соединений можно представить схемой:
Положение спиртов в ряду кислородсодержащих соединений можно представить схемой:
Из этой схемы видно, что спирты являются наиболее восстановленными кислородсодержащими органическими соединениями.
Химические реакции спиртов с участием гидроксильной группы -ОН подразделяются на два основных класса:
1. Реакции с разрывом связи -ОН:
а) взаимодействие спиртов с щелочными металлами с образованием алкоголятов:
2R-OH + 2Na ® 2R-ONa + H2
 |
б) реакции спиртов с органическими и минеральными кислотами с образованием эфиров:
в) окисление спиртов под действием бихромата калия до карбонильных соединений. В случае первичных спиртов первыми продуктами окисления являются альдегиды:
R-CH2OH + O ® R-CHO + H2O
которые в дальнейшем окислении могут переходить в кислоты:
R-CHO + O ® R-COOH
 |
Вторичные спирты при окислении дают кетоны:
Окисление третичных спиртов, так же как и дальнейшее окисление кетонов и кислот, может происходить лишь с разрывом связей между атомами углерода.
2. Реакции, сопровождающиеся разрывом связи С-О:
а) внутримолекулярная дегидратация с образованием алкенов
 |
или межмолекулярная дегидратация с образованием простых эфиров:
R-OH + HO-R ® R-O-R + H2O
б) замещение группы -ОН галогеном, например, при действии галогенводородов с образованием галогеналкилов:
R - OH + HCl Û R - Cl + H2O
Многоатомные спирты по свойствам и способам получения похожи на одноатомные. Их отличает только качественная реакция: многоатомные спирты, содержащие две группы -ОН при соседних атомах углерода, образуют ярко-синий раствор со свежеосажденным Cu(OH)2:
 |
Наиболее известным представителем фенолов является гидроксибензол, или собственно фенол, С6Н5ОН. В молекуле фенола неподеленная пара электронов атома кислорода взаимодействует с ароматическим кольцом, при этом электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Это приводит к усилению кислотных свойств и увеличению активности в реакциях замещения в кольце. Так, фенол, в отличие от предельных спиртов, реагирует со щелочами. Кроме того, в отличие от бензола фенол легко реагирует с бромной водой с образованием 2,4,6-трибромфенола.
Далее перейдите к изучению карбонильных соединений – органических соединений, в молекулах которых имеется карбонильная группа >C=O. Их подразделяют на два класса - альдегиды и кетоны. Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода: R-CH=O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами: R-CO-R1.
Запомните, что химические свойства альдегидов и кетонов обусловлены присутствием в их молекуле активной карбонильной группы, в которой двойная связь смещена к более электроотрицательному атому углерода. Для альдегидов и кетонов характерны реакции присоединения по двойной связи С=О, при этом скорость протекания реакций тем больше, чем больше положительный заряд на атоме углерода. Реакции присоединения протекают таким образом, что отрицательно заряженный фрагмент молекулы присоединяется к положительно заряженному атому углерода карбонильной группы, а положительно заряженный фрагмент - к атому кислорода:
 |
В реакции присоединения к альдегидам и кетонам вступают Н2, HCN, NaHSO3, H2O, спирты. Присоединение водорода приводит к восстановлению карбонильных соединений до спиртов.
Кроме реакции присоединения для альдегидов характерны также реакции окисления до карбоновых кислот. Запомните, что взаимодействие альдегидов с аммиачным раствором оксида серебра (реакция серебряного зеркала) и с гидроксидом меди (II) - качественные реакции на альдегиды. Кетоны окисляются только под действием очень жестких окислителей с разрывом углеродного скелета и образованием смеси карбоновых кислот и СО2.
 |
Карбоновыми кислотами называют соединения, содержащие карбоксильную группу:
Карбоксильная группа -СООН формально представляет собой сочетание карбонильной -С=О- и гидроксильной -ОН групп, которые взаимно влияют друг на друга. В группе -СО- атом углерода несет частично положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе -ОН. При этом электронная плотность на атоме кислорода уменьшается и связь О-Н ослабевает. В свою очередь группа -ОН "гасит" положительный заряд на группе -СО-, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Карбоновые кислоты - более сильные кислоты, чем спирты. В водном растворе карбоновые кислоты диссоциируют:
RCOOH ↔ RCOO- + H+
Для них характерны обычные свойства неорганических кислот. Все карбоновые кислоты - слабые по сравнению с сильными неорганическими кислотами. Сила кислот во многом определяется характером радикала, связанного с гидроксильной группой -СООН. Электроноакцепторные радикалы (такие, как ССl3), оттягивающие электронную плотность от карбоксильной группы, увеличивают силу кислоты. Напротив, электронодонорные радикалы (такие, как СН3), увеличивают электронную плотность на карбоксильной группе, уменьшают силу кислоты. Муравьиная кислота НСООН - наименее слабая из предельных карбоновых кислот.
 |
Муравьиной кислоте, в отличие от ее гомологов, присущи некоторые специфические свойства, связанные с наличием в ее молекуле альдегидной группы:
Так, муравьиная кислота вступает в реакцию серебряного зеркала", окисляясь до (NH4)2CO3.
Важное свойство карбоновых кислот связано с превращением их карбоксильной группы -СООН в разнообразные функциональные производные, содержащие группу -СОХ, где Х - атом галогена (в галогенангидридах) или группы NH2 (в амидах), -OR (в сложных эфирах), -OCOR (в ангидридах). Из всех функциональных производных карбоновых кислот наибольшее прикладное значение имеют сложные эфиры. Общая формула сложных эфиров:
 |
где R и R' углеводородные радикалы (в сложных эфирах муравьиной кислоты R - атом водорода). Сложные эфиры образуются из спиртов при действии на них карбоновых кислот (или их производных - ангидридов и хлорангидридов). Главное химическое свойство сложных эфиров - способность к гидролизу. Гидролиз в кислой среде является обратимым:
RCOOR' + H2O ↔ RCOOH + R'OH
В щелочной среде образующаяся кислота превращается в соль и гидролиз становится необратимым.
Особое значение имеют жиры, которые представляют собой природные сложные эфиры трехатомного спирта глицерина.
Природные жиры представляют собой смесь моно-, ди- и триглицеридов, различающихся по кислотному составу. Часто природные жиры содержат в качестве примесей свободные жирные кислоты. Чаще всего в состав жиров входят насыщенные кислоты – пальмитиновая С15Н31СООН и стеариновая С17Н35СООН, а из непредельных – олеиновая С17Н33СООН (с одной двойной связью), линолевая С17Н31СООН (с двумя двойными связями), линоленовая С17Н29СООН (с тремя двойными связями).
Жиры подразделяются по происхождению на растительные (масла) и животные (жиры). Жиры также различаются по кислотному составу, т.е. по относительному содержанию предельных и непредельных кислот. От этого зависят физико-химические свойства жиров, в том числе их консистенция и способность высыхать на воздухе. По этому признаку растительные жиры (масла) подразделяются на: жидкие масла невысыхающие, полувысыхающие и высыхающие; твердые масла.
В общем виде триглицериды имеют следующее строение:

Состав жиров обусловливает их физические и химические свойства. Ознакомьтесь с физическими свойствами жиров. Обратите внимание на то, что для глицеридов характерны общие реакции сложных эфиров, и, с первую очередь, реакции омыления. Помимо этого глицериды проявляют и все те свойства входящих в них жирных кислот, которые зависят от строения радикала последних. Так, глицериды, содержащие остатки непредельных кислот, обладают способностью присоединять галогены, легко окисляются, полимеризуются.
Гидрогенизация жиров. Жидкие жиры и масла путем каталитического присоединения водорода по месту двойных связей, входящих в их состав непредельных кислот, могут быть превращены в твердые жиры. Этот метод называется гидрогенизацией (отверждением) жиров. Впервые он был разработан в 1906 г. русским ученым С.А. Фокиным, а в 1909 г. им же осуществлен в промышленном масштабе. Гидрогенизацию ведут в присутствии мелкораздробленного металлического никеля (катализирует при 60-240оС, давление газа – очищенный водород – 0.3МПа/м2). При этом непредельные триглицериды превращаются в предельные.
 Гидролиз (омыление) жиров. Как сложные эфиры, жиры подвергаются гидролизу с образованием глицерина и смеси высших кислот. Реакцию гидролиза в общем виде можно представить уравнением:
Гидролиз (омыление) жиров. Как сложные эфиры, жиры подвергаются гидролизу с образованием глицерина и смеси высших кислот. Реакцию гидролиза в общем виде можно представить уравнением:
Большое значение имеет гидролиз жиров, осуществляемый путем нагревания их с водой в присутствии едких щелочей. При этом получаются глицерин и смесь солей высших кислот – мыло. Этот процесс является основным в мыловаренном производстве. Он называется омылением жиров.

|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1027; Нарушение авторских прав?; Мы поможем в написании вашей работы!