
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ТЕМА 12. Химическая кинетика и катализ
|
|
|
|
Методика решения типовых задач
Задача: Найти тепловой эффект реакции сгорания метана.
Решение. 1. Пишем уравнение реакции сгорания метана:
СН4 (Г) + 2О2 (Г) = СО2 (Г) + 2Н2О (Ж) + DНх
2. Согласно следствию из закона Гесса, составляем формулу решения:
DНх = (DНобр.СО2 + 2DНобр.Н2О) - DНобр.СН4
3. Находим по таблице теплоты образования СО2 (г), Н2О (ж), СН4 (г) в кДж/моль и подставляем найденные значения в формулу. Получаем:
DН=(-393,5 - 2.286) - (-75)= -965,5+75= -890,5 кДж/моль
или DНх = - 212,5 ккал/моль.
Для того чтобы DН выразить в ккал/моль, надо полученный результат в кДж/моль разделить на 4,19, так как 1 ккал/моль = 4,19 кДж/моль.
Задача: Вычислить тепловой эффект реакции образования этилового спирта из простых элементов, если теплота его сгорания DНсгор.С2Н5ОН = - 1368,7 кДж/моль.
Решение. 1. Составляем уравнение реакции образования этилового спирта из элементов:
2С + 3Н2 + О2 = С2Н5ОН + DНобр.
2. Согласно следствию из закона Гесса, пишем формулу решения:
DНобр. = (2DНсгор.С + 3DНсгор.Н2) - DНсгор.С2Н5ОН
3. Теплота сгорания простых веществ (С, Н2 и т.п.) равна теплоте образования их окислов. Поэтому из табл. 3 находим
DНсгор.Н2=DНобр.Н2О(ж)=-286 кДж/моль,
DНсгор.С= DНобр.СО2=-393,5 кДж/моль
Подставляя эти значения и значение DНсгор.С2Н5ОН = - 1368,7 кДж/моль в формулу решения, получаем
DНобр. = [2.(-393,5) - 3.286]+1368,7 = - 1645 + 1368,7 = -276,3 кДж/моль.
Основные вопросы
Скорость химической реакции и методы ее регулирования. Средняя и истинная скорость реакции. Закон действующих масс. Константа скорости, ее физический смысл, независимость от концентрации или давления реагирующих веществ. Понятие о молекулярности и порядке реакции. Реакции первого и второго порядка. Период полупревращения, взаимосвязь с исходной концентрацией реагентов.
Влияние температуры на константу скорости химической реакции. Эмпирическое правило Вант-Гоффа. Уравнение Аррениуса для константы скорости реакции. Энергия активации, ее физический смысл. Изменение энергии системы в ходе экзотермической и эндотермической реакции.
Катализ. Гомогенный и ферментативный катализ; автокатализ. Адсорбция и гетерогенный катализ. Механизм действия катализаторов. Специфичность катализаторов.
Обратимость химических реакций. Химическое и фазовое равновесие. Равновесие в гомо- и гетерогенных системах. Константа равновесия. Условия смещения химического равновесия. Принцип Ле-Шателье.
Значение кинетических исследований в пищевых и непищевых системах для оценки качества продуктов и установления срока их хранения.
Методические указания
Ключевым понятием химической кинетики является понятие скорости химической реакции. Скорость реакции - число актов взаимодействия, происходящих в единицу времени: для гомогенных - в единице объема, для гетерогенных - на единице поверхности раздела фаз.
Скорость реакции можно характеризовать изменением во времени концентраций реагирующих веществ (С моль/л, t - в сек). Так как в общем случае концентрация реагирующих веществ непрерывно меняется, то следует рассматривать мгновенную скорость реакции V, т.е. скорость в данный момент времени t. Она выражает изменение количества n реагирующих веществ в единицу времени в единице объема v реакционного пространства
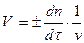
Для гомогенных реакций в большинстве случаев:

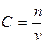 - концентрация любого реагента
- концентрация любого реагента
dC < 0 для исходных веществ; dC > 0 для продуктов
1) Исходные вещества dC < 0; dt > 0
2) Для продуктов dC > 0; dt > 0
Химические реакции подразделяют на:
· элементарные - происходит один процесс и уравнение реакции раскрывает ее механизм;
· сложные - суммарный результат нескольких элементарных процессов; обычная запись этих реакций не раскрывает реальный механизм.
Скорость реакции зависит от следующих факторов:
1. природы и концентрации реагентов;
2. давления (для газов);
3. температуры
4. катализатора;
5. примесей;
6. степени измельченности (для твердых веществ);
7. среды (для растворов).
Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
В 1864 - 1867 гг. Гульберг и Вааге открыли закон действия масс, согласно которому скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам, (вероятность столкновения молекул и, следовательно, их взаимодействия, пропорциональна произведению концентраций компонентов).
А + В «АВ
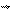
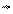
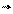 V = k . [A][B]
V = k . [A][B]
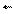
 k - коэффициент пропорциональности - константа скорости прямой реакции.
k - коэффициент пропорциональности - константа скорости прямой реакции.
Обратная реакция: V = k . [AB]

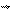 Скорость V будет снижаться V - возрастать. Спустя некоторое время скорости встречных процессов сравняются:
Скорость V будет снижаться V - возрастать. Спустя некоторое время скорости встречных процессов сравняются:

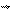 V = V
V = V
Начиная с этого момента число образовавшихся и распавшихся молекул АВ будет одинаковым. В системе наступит подвижное (динамическое) равновесие:
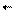


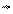 k [A][B] = k [AB]; k / k =
k [A][B] = k [AB]; k / k =  ; в уравнение подставлены равновесные концентрации.
; в уравнение подставлены равновесные концентрации.
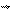

 - константа химического равновесия КС = k / k;
- константа химического равновесия КС = k / k;

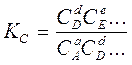
Далее необходимо разобраться в понятиях «молекулярность» и «порядок реакции». Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. Выясните, как классифицируют реакции по этому признаку.
Вероятность одновременного соударения многих частиц очень мала, поэтому тримолекулярные реакции очень редки, а четырехмолекулярные неизвестны.
Сумма показателей степеней в кинетических уравнениях называется общим порядком реакции. Порядок реакции определяет характер зависимости скорости от концентрации. Порядок может не совпадать с молекулярностью: когда процесс многостадийный и запись уравнения реакции лишь фиксирует исходное и конечное состояние и тогда, когда по условиям эксперимента различие концентраций реагентов весьма велико.
2N2O5 ® 4NO2 + O2
N2O5 ® N2O3 + O2 k1
N2O5 + N2O3 ® 4NO2 k2
V1 = k1 [N2O5]
V2 = k2[N2O5].[N2O3] = k3[NO2]
k3 >>> k1
C12H22O11 + H2O ® C6H12O6 + C6H12O6
[H2O] = const
V = k[C12H22O11][H2O] = k1[C12H22O11]
Реакция первого порядка.
Затем перейдите к рассмотрению зависимости константы скорости от температуры. Скорость химических реакций в большинстве случаев при повышении температуры возрастает. Она очень чувствительна к повышению температуры.
Правило Вант-Гоффа (1884г.): при повышении температуры на каждые 10О скорость гомогенной реакции увеличивается обычно в 2 - 4 раза.

n - коэффициент = 2 ¸ 4
Аррениус (1889г.), основываясь на огромном разрыве между числом молекул, вступающих в реакцию (активных молекул), и числом столкновений, а также на характере зависимости скорости реакции от температуры, предложил уравнение, выражающее зависимость константы скорости от температуры:
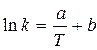
a и b - постоянные для данного процесса
a = -E / R и b = lnA
Е - энергия активации
R - универсальная газовая постоянная

A - предэкспоненциальный множитель или фактор частоты
Запомните, что реакционными являются лишь те частицы, энергия которых выше некоторой величины, ей соответствует порог скорости UE.
Энергия активации - та минимальная избыточная (по сравнению со средней) энергия теплового движения некоторых молекул в реакционной смеси, благодаря которой при столкновении молекул возможно химическое взаимодействие.
Доля активных молекул в реакционной смеси обычно мала
NE =  dU - число реакционноспособных молекул
dU - число реакционноспособных молекул
Величина 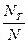 характеризует реакционную способность рассматриваемой совокупности частиц.
характеризует реакционную способность рассматриваемой совокупности частиц.
Доля активных молекул быстро растет с повышением температуры и это обусловливает аналогичную температурную зависимость скорости реакции. Большую скорость будут иметь те реакции, для которых мала энергия активации (при одинаковых значениях t, C и А).
Разность энергий активации прямой и обратной реакции равна тепловому эффекту (т.к. она энергетический барьер, который отделяет активированный комплекс от вступающих в реакцию веществ).
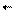
 DU = E - E
DU = E - E
 |  |  | 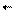 |
DU > 0 (эндотермический эффект) Е - Е > 0 E > E
 |  | 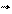 | 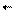 |
DU < 0 (экзотермический эффект) Е - Е < 0 E < E
Значение энергии активации легко определить по наклону прямой
ln k = T-1 (E = - a R)
Для большинства процессов она лежит от 50 до 250 кДж / моль.
Для реакций с участием атомов и радикалов (в соответствии с их большой реакционной способностью) она меньше 50 кДж / моль, а для взаимодействия ионов близка к нулю.
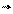


 К в отличие от k и k меняется мало при изменении температуры, т.к. с увеличением V растет и V.
К в отличие от k и k меняется мало при изменении температуры, т.к. с увеличением V растет и V.
Из уравнения k = A.e-E/RT следует, что чем больше Е, тем значительнее влияние температуры на скорость реакции, а малое изменение Е сильно изменяет скорость процесса.
Затем перейдите к рассмотрению каталитических процессов. Вспомните, что катализатор – вещество, которое изменяет скорость реакции, само оставаясь химически неизменным.
МnO2
 2H2O2 2H20 + O2
2H2O2 2H20 + O2
Автокатализ - когда катализатором служит один из продуктов реакции.
Гомогенный – катализатор находится в той же фазе, что и реагирующие вещества; гетерогенный – образует самостоятельную фазу (каталитическое действие поверхности твердого тела (катализатора). Часто применяют переходные металлы, оксиды и другие соединения. В гомогенном катализе - кислоты, основания, соли d-элементов (Cr, Mn, Fe, Co, Ni, Cu и др.)
Катализаторы отличаются селективностью (избирательностью) действия. Катализатор не влияет на истинное равновесие, т.е. не меняет К и С равновесия. Он в равной степени ускоряет прямую и обратную реакции. Катализатор изменяет время достижения равновесия. Оно тем меньше, чем активнее катализатор. Посторонние вещества, усиливающие действие катализатора - промоторы или активаторы. Каталитические яды - вещества, отравляющие катализатор.
Рыхлый, неустойчивый катализатор со значительной поверхностью является более активным. Готовятся при низких температурах (частицы не могут перегруппироваться в более устойчивые формы).
Затем остановитесь на рассмотрении механизма действия катализатора.
Гомогенный катализ: катализатор образует в той же фазе промежуточные реакционноспособные продукты
А + В = АВ
+ катализатор
А + К = АК; АК + В = АВ + К - две быстро протекающие стадии, в результате которых последовательно образуются частицы промежуточного соединения АК (затем активный комплекс АВК) и конечные продукты с регенерацией катализатора.
Гетерогенный катализ: Начальная стадия - диффузия частиц исходных реагентов к катализатору и поглощение частиц его поверхностью (активированная адсорбция). Последний процесс вызывает сближение молекул и повышение их химической активности, при этом под влиянием силового поля поверхностных атомов катализатора изменяется структура электронных оболочек молекул и, как следствие, понижается активационный барьер. В результате на катализаторе происходит реакция. Затем продукты взаимодействия покидают катализатор и переходят в объем. Таким образом, в гетерогенном катализе образуются промежуточные поверхностные соединения. Наиболее медленная из указанных стадий определяет скорость процесса в целом. Ускоряющее действие катализатора связано с тем, что реагирующие вещества образуют промежуточные соединения, что приводит к снижению энергии активации.
Процесс формирования промежуточных поверхностных соединений происходит на активных центрах катализатора. Силовые поля активных центров ослабляют связи между атомами адсорбированных молекул, что приводит к возрастанию реакционной способности.
Активные центры составляют небольшую долю всей поверхности катализаторов. Это подтверждается действием каталитических ядов, блокирующих активные центры; ничтожное количество их уменьшает активность катализатора или выводит из строя большие его массы. Путем дозировки отравления можно даже определить число активных центров на поверхности катализатора.
Катализатор измельчают для увеличения числа активных центров. Катализатор обычно наносят на инертный носитель с развитой поверхностью (осаждают) (силикагель, асбест, пемза). Важно число активных центров и характер их расположения. Чем больше соответствие между расположением атомов в адсорбируемом веществе и расположением активных центров на поверхности катализатора, тем он активнее. Геометрическое соответствие проявляется в близости значений межатомных расстояний в кристаллической решетке катализатора и молекулах реагентов, а также в сходном расположении атомов в решетке и молекулах, что обеспечивает интенсивное взаимодействие реагента с катализатором при адсорбции. Если число активных центров или их расположение не соответствуют структуре молекул реагирующих веществ, процесс ускоряться не будет.
Затем перейдите к рассмотрению состояния химического равновесия и возможностей его смещения. Для этого вспомните принцип Ле Шателье (1884). “Если на систему, находящуюся в истинном равновесии, подействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении”.
Это связано с тем, что внешнее воздействие в разной степени изменяет скорость двух взаимно противоположных процессов.
Равновесное состояние - термодинамическое состояние системы, которое при постоянных внешних условиях не изменяется во времени, причем стабильность характеристик системы (состав, давление и др.) не обусловлено протеканием какого-либо процесса с участием внешней среды.
Истинное равновесие является динамическим - обусловлено протеканием с одинаковой скоростью прямого и обратного процессов. В результате обратимого процесса в системе наступает истинное равновесие (устойчивое).
1. Система следует за изменением внешних воздействий.
2. При отсутствии их - она неизменна во времени.
3. При прекращении внешних воздействий система возвращается в состояние равновесия.
4. При истинном равновесии между действием и его результатом - количественная связь.
5. Состояние системы не зависит от того, с какой стороны она к нему подошла.
СО + Н2О «СО2 + Н2
Кажущееся равновесие - заторможенное равновесие - метастабильное состояние - неизменность во времени (нефть, горючие вещества - в контакте с воздухом не горят, но при изменении условий происходят односторонние процессы, сопровождающиеся выделением большого количества теплоты).
Гремучая смесь:
Н2 + 1/2 О2 = Н2О
Принцип Ле Шателье справедлив и для равновесных систем, не связанных с химическими превращениями (кипение, кр-я, растворение и т.д.). Не применим к системам в кажущемся равновесии.
I. Влияние температуры на равновесие.
Повышение температуры вызывает возрастание константы равновесия эндотермического процесса.
Направление смещения процесса определяется знаком теплового эффекта. Степень смещения равновесия определяется абсолютной величиной теплового эффекта; чем больше DН, тем значительнее влияние температуры.
DН ® 0, температура практически не влияет на равновесие.
DН0 - TDS0 = - RT lnK
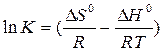
По наклону прямой, выражающей зависимость lnK от 1/Т можно определить DН0 реакции
II. Влияние давления на равновесие
Сжатие смещает химическое равновесие в направлении процесса, сопровождающегося уменьшением объема, а понижение давления вызывает сдвиг равновесия в сторону увеличения объема. Направление смещения определяется знаком DV. Степень смещения - абсолютной величиной DV.
N2 + 3H2 «2NH3
III. Влияние концентрации на равновесие
Введение дополнительного количества реагента смещает равновесие в направлении уменьшения его концентрации.
Направление смещения определяется тем, какой реагент взят в избытке. Степень определяется стехиометрическими коэффициентами участвующих в реакции веществ.
В систему вводят инертные газы (уменьшая концентрацию реагентов); выводят продукты реакции.
Наконец, разберите понятие фазового равновесия, выясните суть понятий «степень свободы» и «число независимых компонентов».
Изменение внешних условий без нарушения устойчивости фазы - степень свободы.
Число независимых компонентов - есть наименьшее число участвующих в образовании системы веществ, необходимое для того, чтобы выразить химический состав всех фаз.
Правило фаз Гиббса (1878г.) связывает друг с другом число фаз, степеней свободы и независимых компонентов любой равновесной системы. Если влияющими на состояние равновесия внешними условиями являются только температура и давление, то правило это формулируется следующим образом: число степеней свободы плюс число фаз равно числу независимых компонентов плюс 2.
Например, для системы: СаСО3 «СаО + СО2
С + Ф = К + 2
С + 3 = 2 + 2, то есть С = 1 - одна степень свободы
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 629; Нарушение авторских прав?; Мы поможем в написании вашей работы!