
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибкость ДНК позволяет регуляторным белкам, связывающимся с отдаленными участками, влиять на
|
|
|
|
10-10
10-9
10.2.3. Изменения в фосфорилировании белков могут влиять на активность генов [11]
Все ранние работы по белкам-репрессорам были выполнены на бактериях. Выяснилось, что и у лактозного, и у триптофанового оперона активность этих белков контролируется посредством обратимого связывания небольших специфических молекул. В клетках эукариот белки-
регуляторы тоже находятся под контролем небольших сигнальных молекул, таких, например, как сАМР. Эти молекулы осуществляют свое воздействие непрямым путем, влияя на фосфорилирование и дефосфорилирование белка. Хотя у бактерий фосфорилирование не играет такой важной роли в регуляции, и у них существует одна хорошо изученная система контроля, зависящая от фосфорилирования белков. На примере этой системы мы рассмотрим некоторые аспекты регуляции генов, знание которых способствует пониманию более сложной системы регуляции высших эукариот.
Известно, что у бактерий родственные белки контролируют азотный и фосфатный обмен, синтез белков мембраны, хемотаксис и споруляцию. Здесь будет рассмотрен азотный обмен у Е. coli, в котором синтез ряда белков усиливается при нехватке азота. К таким белкам относится глутаминсинтетаза - фермент, играющий наиболее важную роль в усвоении азота и катализирующий реакцию: глутаминовая кислота +
аммиак → глутамин.
В активации генов азотного обмена участвует два основных регуляторных компонента: белок ntrC, активирующий белок, способный включать гены лишь тогда, когда он фосфорилирован (ntrС-фосфат), и белок ntr В, который может либо фосфорилировать (благодаря своей киназной активности), либо дефосфорилировать (благодаря своей фосфатазной активности) белок ntrC. Фосфорилирование ntrC происходит в ходе реакций, запускающихся снижением уровня азота, при этом остатки уридинмонофосфата (UMP) присоединяются к регуляторной субъединице ntr В. Такая модификация повышает относительную киназную активность фермента ntr В.
Потребность в азоте определяется соотношением α-кетоглутарата и глутамина, повышение этого показателя стимулирует фосфорилирование ntr С и, таким образом индуцирует транскрипцию гена глутаминсинтетазы (рис. 10-15). Аналогичные цепочки реакций модификации белков происходят и в клетках эукариот, они тоже приводят к фосфорилированию или дефосфорилированию белков-регуляторов, хотя детали этого процесса изучены гораздо хуже.
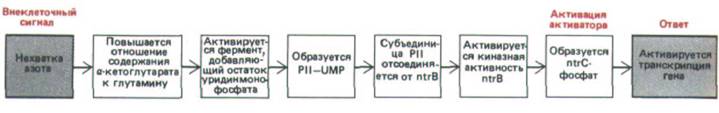
Рис. 10-15. Часть регуляторного каскада, который при нехватке азота активирует гены, участвующие в метаболизме азота у бактерий.
Белок Р II служит регуляторной субъединицей белка ntrB. Преимущество подобной многоступенчатой регуляции состоит в том, что она может вызывать значительные изменения в метаболизме в ответ на относительно небольшие изменения в содержании азота. Побочные ответвления этой цепи также обратимо модифицируют другие ферменты, контролируя их каталитическую активность в ответ на изменения концентрации азота.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 10-16. Регуляторная область бактериального гена глутамин-синтетазы. Глутамин-синтетаза катализирует реакцию глутаминовая кислота + аммиак → глутамин. Два ярко окрашенных на рисунке сайта связывают белок ntrC особенно сильно и необходимы для активации транскрипции.
транскрипцию генов [11, 12]
Только что описанная двухкомпонентная регулирующая система у бактерий имеет много общего с системой контроля эукариотических генов. Дело в том, что в ДНК существует два сильных участка связывания для белка ntrC, которые расположены на расстоянии 100 или более нуклеотидных пар перед промотором гена глутаминсинтетазы (рис. 10-16). В фосфорилированной форме ntrC (ntrC-фосфат) связывается с ними, и эти два сайти эффективно стимулируют транскрипцию. Более того, стимуляция наблюдается, даже если эти участки «отодвинуть» (методами генетической инженерии) от промотора более чем на ТОО нуклеотидных пар.
Если в отношении прокариот такое «действие на расстоянии» нельзя назвать чем-то необычным, а отношении эукариот этот феномен следует признать широкораспространенным. У прокариот имеется надежное доказательство того, что белки, связавшиеся с отдаленными участками ДНК, действуют по преимуществу так же, как и белки, присоединенные к соседним областям. Например, белок nlrC усиливает способность РНК-
полимеразы связываться с промотором и образовывать открытый инициаторный комплекс (см. рис. 9-65). Разделяющая эти сайты ДНК формирует петлю, что позволяет белкам, связавшимся в отдаленных участках, взаимодействовать с полимеразой (рис. 10-17). Такое взаимодействие происходит довольно легко, поскольку ДНК действует как «ограничитель» и белок, связавшийся даже на расстоянии нескольких тысяч нуклеотидных пар, постоянно сталкивается с промотором (рис. 10-18).
10.2.5. Различные сигма-факторы позволяют бактериальной РНК-полимеразе узнавать разные промоторы [11, 13]
В гл. 9 шла речь о том, что у бактерий существует еще один тип контроля генной активности на уровне транскрипции. При обсуждении строения бактериальной РНК-полимеразы отмечалось, что одна из составляющих ее пяти основных полипептидных цепей-сигма (δ) фактор -
функционирует как фактор инициации. Этот фактор отделяется от ДНК в гот момент, когда полимераза начинает синтез РНК (см. разд. 9.4.1). У бактерий консенсусная последовательность транскрибируемого промотора узнается основной формой РНК-полимеразы, содержащей субъединицу δ70. Однако существуют и минорные формы полимераз, в состав которых входят δ-субъединицы, узнающие другие последовательности промотора.
Например, субъединица δ54 является продуктом гена ntrA и наряду с белками ntr В и ntr C необходима именно для
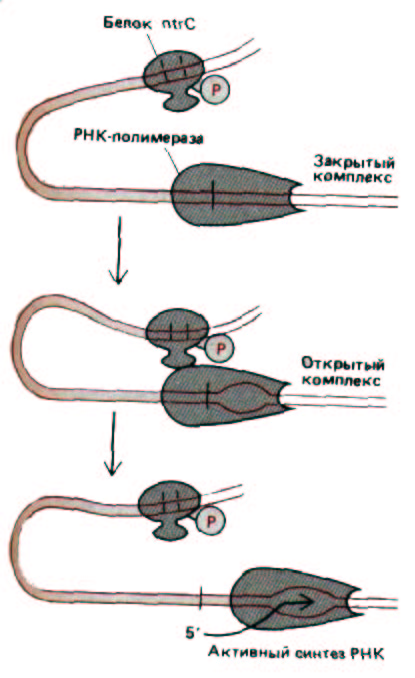
Рис. 10-17. Схема энхансерного воздействия белка ntrC на синтез РНК гена глутамин-синтетазы E. coli. Связываясь с расположенными перед геном последовательностями ДНК, этот регуляторный белок повышает скорость транскрипции РНК-полимеразой. Хотя белок присоединяется к этим сайтам даже когда он не фосфорилирован, лишь фосфорилированная форма (ntrC-фосфат) может активировать транскрипцию. Вероятно, для функционирования белка необходимы контакты с полимеразой, которые увеличивают присущую этому ферменту способность раскручивать ДНК и образовывать открытый комплекс (см. рис. 9-65), как показано на рисунке (см. рис. 10-18).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
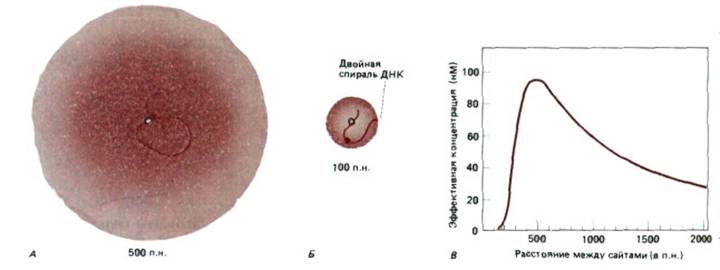
Рис. 10-18. Присоединение двух белков к отдельным сайтам на двойной спирали ДНК может в значительной мере повысить вероятность их взаимодействия. А. Связывание белков с помощью петли ДНК размером 500 нуклеотидных пар повышает частоту их сталкивания.
Интенсивность цвета отражает вероятность того, что окрашенный белок будет располагаться в каждой из точек пространства, окружающего белок, обозначенный белым кружочком. Б. Гибкость ДНК такова, что обычная последовательность образует плавный изгиб под углом 90° (изогнутый виток) примерно один раз на каждые 200 нуклеотидных пар. Следовательно, если два белка разделены всего лишь 100 нуклеотидными парами, их контакты относительно ограничены. В таких случаях взаимодействие белков облегчается, если они расположены на одной и той же стороне спирали ДНК (содержащей 10 нуклеотидов на виток). В. Эффективность концентрации окрашенного белка в сайте связывания белого белка как функция разделяющего их расстояния. (С любезного разрешения Gregory Bellomy, по М.С. Mossing and M.T. Record, Science 233: 889-892, 1986.)
транскрипции гена глутаминсинтетазы. Вполне возможно, что изменения в окружающей среде могут включать специфический набор генов благодаря синтезу определенного сигма-фактора.
Как отличить фактор инициации РНК-полимеразы, например, δ54, влияющий на узнавание промотора, от белка-регулятора, такого например, как ntrC? Один из подходов к решению этой задачи основан на том, что δ-факторы прочно соединяются с РНК-полимеразой, но сами по себе не способны связаться с определенными последовательностями ДНК. В отличие от них белки-регуляторы связываются именно с ДНК, но не с РНК-полимеразой. Другой подход учитывает тот факт, что в определенный момент времени с молекулой РНК-полимеразы объединяется лишь одна σ-субъединица. Меняя соотношение известного σ-фактора, например σ70, и испытуемого белка в опытах по транскрипции in vitro, можно прийти к определенному выводу. Если σ70 подавляет транскрипцию пропорционально этому соотношению (кон-
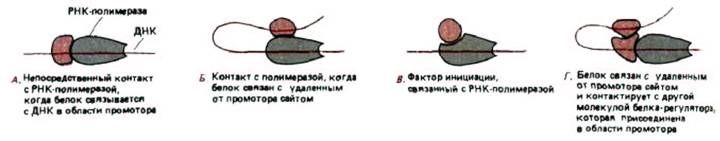
Рис. 10-19. Механизм, посредством которого белки контролируют инициацию транскрипции РНК в бактериальных клетках. Белки могут воздействовать либо стимулируя, либо блокируя ряд стадий, необходимых для начала продуктивного синтеза РНК (см. рис. 9-65). Механизм (Г)
был впервые открыт при изучении арабинозного оперона Е. coli. Он представляет собой комбинацию механизмов А и Б, и это единственный из четырех механизмов, до сих пор не обсуждавшийся в тексте. Данный вариант будет разобран ниже на примере эукариот (см. рис. 10-27).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
курентное подавление), то исследуемый белок выполняет функцию σ-субъединицы.
Основные типы механизмов, регулирующих инициацию транскрипции генов у бактерий, представлены на рис. 10-19. Бактериальные системы будут рассмотрены и при обсуждении того, как при конкурентном взаимодействии между белками-регуляторами, может осуществляться молекулярное переключение.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 794; Нарушение авторских прав?; Мы поможем в написании вашей работы!