
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Два белка бактериофага, подавляющие синтез друг друга, могут участвовать в стабильном переключении
|
|
|
|
10-18
10-17
10.3.2. Главный регуляторный лоrус определяет тип спаривания у дрожжей [21]
Дрожжи - это одноклеточные эукариоты, которые могут существовать как в гаплоидном, так и в диплоидном состоянии. Диплоидные клетки образуются в ходе спаривания, при котором две гаплоидные клетки сливаются (см. рис. 13-17). Чтобы это произошло, гаплоидные клетки должны различаться по типу спаривания (по полу). У обычных пекарских дрожжей Saccharomyces cerevisiae существуют два типа спаривания а и а.
Клетки двух типов приспособлены для спаривания друг с другом: каждая из них образует диффундирующие сигнальные и рецепторные молекулы, благодаря которым клетки противоположного типа спаривания способны узнавать друг друга и сливаться. Образовавшиеся в результате диплоидные клетки, обозначаемые α/а, обладают иными свойствами и отличаются от каждого из родительских типов. Диплоидные клетки не способны спариваться, но могут формировать споры, которые при мейозе дают начало гаплоидным клеткам.
Генетические изменения, обусловливающие существование трех типов дрожжевых клеток, основаны на действии главных генов-
регуляторов. Главные регуляторные белки кодируются единственным локусом, который называется локусом типа спаривания (mating type locus, MAT). Совместное действие этих белков детерминирует тип клетки, определяя транскрипцию многих генов. Механизм действия главных регуляторных белков в данном случае известен (рис. 10-29), и на его примере можно проиллюстрировать принцип комбинационного контроля, описанного выше (см. разд. 10.1.5).
Образование трех главных регуляторных белков, определяющих тип спаривания у дрожжей (белки α1 α2 и а1 само по себе также контролируется, поскольку гаплоидные клетки дрожжей регулярно переключают свой тип спаривания. Молекулярный механизм, ответственный за такое переключение в ходе развития, по-видимому, характерен только для дрожжей: тип клетки зависит от того, какая из двух последовательностей ДНК а (кодирующая белки α1 и α2) или а (кодирующая белок a1 находится в данный момент в локусе МАТ; изменение типа спаривания возникает в результате замены ДНК в этом локусе. Всякий раз, когда

Рис. 10-29. Тип клеток у дрожжей определяется дрожжевыми белками-регуляторами, кодируемыми локусом МАТ. В гаплоидных клетках типа а, в гаплоидных клетках типа α и в диплоидных клетках (типа а/α) транскрибируются различные наборы генов. Гаплоидные клетки экспрессируют либо набор генов αSG (α-специфические гены), либо набор aSG (а-специфические гены) плюс набор hSG (гаплоид-специфические гены). В диплоидных клетках ни один из этих генов не экспрессируется. Белки α1, α2 и a1, детерминируемые локусом МАТ, связываются (поодиночке или в сочетаниях) с определенными последовательностями ДНК в элементах, расположенных перед промотором, и, таким образом, действуют как главные белки-регуляторы. Следует отметить, что белок Α1 является белком-активатором, тогда как белок α2-это белок-репрессор.
Сам по себе белок а1 не оказывает никакого действия (а следовательно, клетка, не содержащая локус типа спаривания, принадлежит к типу а).
Однако при одновременном синтезе белков а1 и α2 они образуют комплекс, включающий иной набор генов, чем белок α2, действующий сам по себе.
Таким образом, простая система из трех белков служит хорошим примером принципа комбинаторного контроля генов, представленного на рис. 10-
7.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
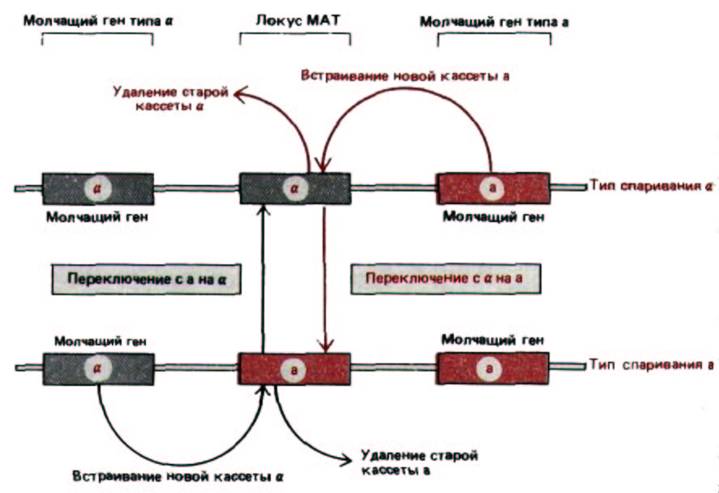
Рис. 10-30. Кассетная модель переключения типа спаривания у дрожжей. Кассетное переключение происходит в ходе процесса конверсии гена, запускаемого, когда нуклеаза НО делает двухцепочечный разрез в определенной последовательности ДНК локуса МАТ. ДНК вблизи разреза затем удаляется и заменяется копией молчащей кассеты, определяющей противоположный тип спаривания.
клетки α-типа превращаются в клетки α-типа, ген а в локусе МАТ вырезается и замещается вновь синтезированным геном α, скопированным с молчащей копии, расположенной в другом месте генома. Поскольку в данном случае из активного «места» удаляется один ген, а на его место встает другой, этот механизм называют кассетным. Изменение может быть обратимым, поскольку при удалении гена а из локуса МАТ в геноме остается его молчащая копия. Копии молчащих генов а и α действуют как кассеты, «вставленные» в локус МАТ, который можно сравнить с «проигрывателем» (рис. 10-30).
10.3.3. Способность переключать тип спаривания наследуется асимметрично [22, 23]
Переключение типа спаривания инициируется сайт-специфической эндонуклеазой (НО-эидонуклеазой), являющейся продуктом гена НО, Этот фермент делает двухцепочечный разрез в ДНК локуса МАТ, в результате эта область вырезается и затем ресинтезируется, при этом матрицей служит молчащий ген противоположного типа спаривания (рис. 10-30). Транскрипция гена НО, определяющего, когда и где происходит переключение, строго контролируется. С помощью генетического анализа было показано, что контроль обеспечивают по меньшей мере шесть регуляторных генов (от SWI 1 до SWI 6). В связи с тем, что при почковании дрожжевые клетки делятся асимметрично, одна из двух образовавшихся клеток больше («материнская»), чем другая («дочерняя»). Большинство материнских клеток в ходе дальнейшего роста переключает тип спаривания, а вновь образовавшиеся дочерние клетки (возникающие из почки) не синтезируют продукт гена НО и не способны переключаться до тех пор, пока при делении они не станут материнскими клетками (рис. 10-31). Асимметрия переключения оказалось связанной с асимметричным наследованием белка SWI 5, который присоединяется к ДНК перед геном НО и необходим для его транскрипции. Полагают, что белок SWI5 (либо его активная форма) наследуется лишь материнской клеткой. Остается непонятным, почему этого белка нет в почке, но характер его наследования может служить моделью асимметричной сегрегации некоторых признаков, наблюдаемой у высших эукариот.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 10-31. Переключение типа спаривания в гаплоидных клетках S. cerevisiae. А. Экспрессия гена в ходе клеточного цикла дрожжей. В соответствии с приведенной схемой тип спаривания может переключаться лишь в клетках, унаследовавших сайт-специфический ДНК-
связывающий белок SW15, необходимый для транскрипции гена НО. Более того, переключение может происходить только в фазе G1 это единственный отрезок времени в ходе клеточного цикла, когда может синтезироваться эвдонуклеаза НО (после окончания синтеза этот белок быстро исчезает, вероятно, в результате интенсивного протеолиза). Так как после каждого переключения происходит репликация ДНК, делящаяся клетка всегда образует две клетки одного и того же типа спаривания. Б. Схема переключения. Деление клеток осуществляется почкованием. После каждого деления можно различить большую «материнскую» и маленькую «дочернюю» клетки. Оказалось, что вновь образованные дочерние клетки не способны переключать свой тип спаривания (обозначенный на этом рисунке разными цветами) до того, как они пройдут через митоз в качестве материнских клеток и вступят в следующую фазу G1. По-видимому, подобная асимметрия отражает асимметричное наследование белка SW15
(обозначенного здесь как S).
10.3.4. Сайленсер, вероятно, «закрывает» участок хроматина у дрожжей [23, 24]
Если бы кодирующие последовательности двух молчащих генов, которые определяют тип спаривания, были лишены промоторов, механизм их активации при перемещении в локус МАТ, вероятно, был бы аналогичен фазовой вариации. Однако определение первичной структуры ДНК показало, что молчащие гены обладают всеми регуляторными сайтами, необходимыми для транскрипции. Эти гены сохраняются в молчащем состоянии благодаря расположенной за ними на некотором расстоянии последовательности ДНК, которая каким-то образом блокирует их экспрессию. Механизм действия таких сайленсеров неизвестен, тем не менее удалось идентифицировать некоторые белки, опосредующие их функции. Это оказалось возможным вследствие того, что у мутантов, дефектных по одному из четырех генов SIR (silent information regulator), экспрессия молчащих кассет все же происходит. Для действия белков SIR необходима сайленсерная последовательность ДНК, причем репрессируются все гены, расположенные на расстоянии нескольких тысяч нуклеотидных пар от сайленсера. Тот же механизм в норме препятствует вырезанию эндонуклеазой НО ДНК в области молчащих генов типов спаривания, в результате перенос осуществляется из молчащего локуса в локус МАТ, но никогда в обратном направлении.
Тот факт, что белки SIR подавляют и транскрипцию, и действие НО-эндонуклеазы, свидетельствует о том, что эти белки могут вызывать изменения в структуре хроматина дрожжей, способствуя «закрытию» целых областей хроматина, лежащих по соседству; в результате эти области становятся недоступными для самых разных ферментов. Два других наблюдения указывают на то, что в механизме действия сайленсеров есть нечто необычное. Для проявления репрессии необходима репликация ДНК, а последовательность, необходимая для инициации репликации (ARS), является существенной составной частью области сайленсера. Подробное изучение этого нового механизма контроля генетической активности может в какой-то мере прояснить влияние структуры хроматина на активность генов в клетках высших эукариот.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
на молекулярном уровне [25]
До сих пор обсуждались некоторые изменения типов клеток, происходящие по типу переключения, т. е. в результате перестройки ДНК.
Тот факт, что генетическая информация, содержащаяся в единственном ядре соматической клетки, может дать начало целому растению или позвоночному животному, свидетельствует о том, что вряд ли основным механизмом дифференцировки клеток высших эукариот являются необратимые изменения в последовательности ДНК (хотя именно такие изменения лежат в основе дифференцировки лимфоцитов). Возможно, некоторые наследуемые изменения в экспрессии генов, наблюдаемые у высших организмов, обусловлены механизмом переключения, аналогичным тому, который описан у Salmonella и дрожжей, однако в настоящее время нет данных, подтверждающих эту гипотезу.
Ниже будет показано, что за наследуемый тип регуляции генетической активности могут отвечать несколько механизмов. Наиболее известный среди них - механизм переключения, присущий бактериофагу лямбда. От него зависит, будут ли фаговые частицы размножаться в цитоплазме Е. coli (что приведет к гибели клетки) или же геном фага встроится в ДНК хозяйской клетки и будет автоматически реплицироваться вместе с ней. В переключении участвует белок, кодируемый геномом бактериофага. В его состав входит около 50 генов. Эти гены в двух стабильных состояниях транскрибируются совсем по-разному. Так, например, вирус, который собирается включиться, должен синтезировать белок интегразу, необходимый для встраивания ДНК бактериофага в хромосому бактерии, и, кроме того, должен подавить образование вирусных белков, ответственных за размножение вируса (для клетки-хозяина эти белки летальны). После того как установился один или другой тип транскрипции, он уже стабильно поддерживается. В результате включенный в хромосому профаг может не проявляться в геноме £ coli на протяжении тысяч клеточных поколений.
Не останавливаясь здесь на тонкостях этой сложной системы регуляции, опишем некоторые ее общие свойства. Центром всей системы являются два фаговых белка: белок-репрессор (белок сI) и сrо-белок. Каждый из них блокирует синтез другого белка, связываясь с оператором его гена. Присутствие того или другого белка, в свою очередь, включает ряд иных генов, что в конечном итоге приводит к установлению одного из двух стабильных состояний. В состоянии 1 (лизогенное состояние) доминирует лямбда-репрессор, и именно он, а не сrо-белок синтезируется. В состоянии 2 (литическое состояние) доминирует и синтезируется сrо-белок, а не лямбда-репрессор (рис. 10-32). В состоянии 1 большая часть ДНК стабильно включенного в геном клетки-хозяина бактериофага (профага) не транскрибируется. В состоянии 2 фаговая ДНК интенсивно транскрибируется, реплицируется, упаковывается в новые частицы, которые при лизисе клетки выходят наружу.
Характер событий, которые разворачиваются в бактериальной клетке после заражения фагом лямбда, неслучаен. Если клетки хозяйского штамма растут хорошо, бактериофаг скорее всего пойдет по пути лизогенизации, что позволит его ДНК быстро размножатья вместе с хромосомой хозяина. Если клетка, несущая профаг, оказывается по каким-либо причинам ослабленной, фаг переходит из состояния 1 в состояние 2, чтобы размножиться в цитоплазме клетки и быстро выйти из нее. Информацию о статусе клетки-хозяина «поставляют» фагу другие белки, влияющие на переключение белка, репрессора и сrо-белка.
На примере бактериофага лямбда можно убедиться в том, что
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
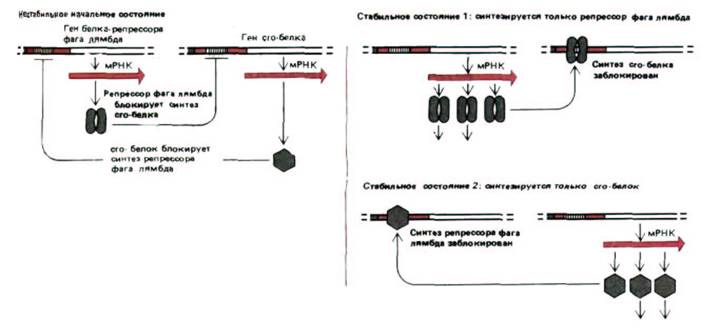
Рис. 10-32. Регуляторная система, определяющая поведение бактериофага лямбда в хозяйских клетках Е. coli. В стабильном состоянии 1
(лизогенное состояние) синтезируются большие количества белка-репрессора фага лямбда. Этот регуляторный белок выключает синтез ряда белков бактериофага, включая сго-белок. В результате фаговая ДНК встраивается в хромосому Е. coli и автоматически дуплицируется вместе с ней по мере роста бактерии. В стабильном состоянии 2 (литическое состояние) синтезируются большие количества сrо-белка. Этот регуляторный белок выключает синтез белка-репрессора фага лямбда. В результате образуется много фаговых белков, вирусная ДНК свободно реплицируется в клетках Е. coli, формируются новые частицы бактериофага, что приводит к гибели клетки. Кооперативное и конкурентное взаимодействие между репрессором лямбда и сrо-белком способствует переключению по типу «все или ничего» между этими двумя состояниями.

Рис. 10-33. Два главных белка-регулятора способствуют молекулярному переключению у эукариот. Следует отметить, что один и тот же белок может оказывать либо активирующее, либо репрессирующее действие на транскрипцию в зависимости от того, с какой последовательностью ДНК он связывается. Примеры такого типа действия, как полагают, встречаются среди ДНК-связывающих белков, контролирующих направление путей развития на ранних стадиях зародыша у дрозофилы.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
относительно сложная модель поведения может определяться немногими белками-регуляторами, которые взаимно контролируют синтез и активность друг друга. Если вспомнить, какое количество белков содержится в эукариотической клетке, возможности, открывающиеся для регуляции активности генов, могут ошеломить.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1195; Нарушение авторских прав?; Мы поможем в написании вашей работы!