
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обширной группы актин-связывающих белков
|
|
|
|
Об актин-связывающих белках сейчас известно куда больше, чем о белках, взаимодействующих с двумя другими важными видами нитчатых
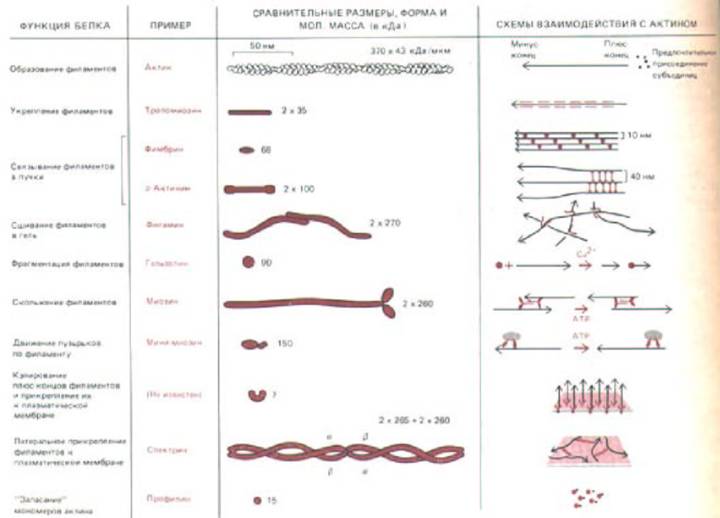
Рис. 11-47. Некоторые главные классы актин-связывающих белков, имеющихся в большинстве клеток позвоночных.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
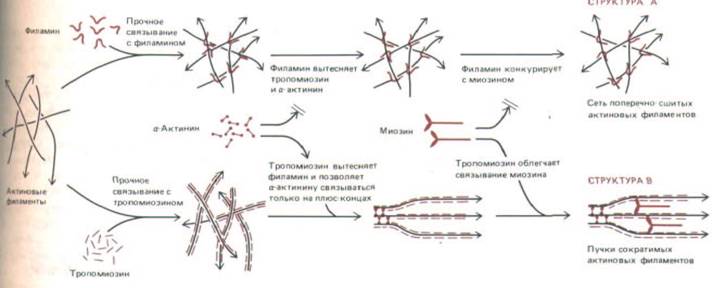
Рис. 11-48. Некоторые примеры конкурентных и кооперативных взаимодействий между актин-связывающими белками. Тропомиозин н филамин прочно связываются сатиновыми филаментами, но при этом конкурируют друг с другом. Так как тропомиозин связывается с актиновыми нитями кооперативно, на обширных участках их сети будет преобладать либо тропомиозин, либо филамин. Другие актин-связывающие белки, такие как и актинин или миозин, будут конкурентно вытесняться из специфических участков; например, а-актинин in vitro связывается по всей длине очищенных актиновых филаментов, но с такими же филаментами в клетке он связывается относительно слабо - там он находится в основном вблизи плюс-концов из-за конкуренции с другими белками. Напротив, кооперативные взаимодействия могут усиливать связывание; так, тропомиозин, по-видимому, способствует связыванию миозина. Как полагают, множество подобных взаимодействий между актин-связывающими белками, представленными на рис. 11-47 (и некоторыми другими), обусловливает необычайное многообразие актиновых структур во всех эукариотических клетках.
цитоскелетных структур - промежуточными филаментами и микротрубочками. Наши знания о тех актин-связывающих белках немышечных клеток позвоночных, которые мы рассмотрели в этой главе, резюмированы на рис. 11-47. Эта картина далека от завершения; каждая из указанных здесь функциональных категорий включает несколько их представителей, свойства которых слегка различаются. Кроме того, известны актин-
связываюшие белки без каких-либо очевидных функций, и несомненно также, что существуют еще не открытые актин-связывающие белки. В частности, клетки должны как-то различать противоположные концы актиновых филаментов и контролировать их ориентацию и местонахождение в цитоплазме. По-видимому, в механизмах такого различения используются «кэшрующие белки», которые избирательно связываются с плюс-
концами актиновых филаментов, удерживают их вблизи плазматической мембраны и регулируют присоединение мономеров актина. В отличие от этого минус-концы, относительно инертные в отношении как полимеризации, так и деполимеризации, возможно, часто остаются «открытыми».
Немало еще предстоит узнать о природе мембраносвязанных центров организации актина; например, почти ничего не известно о молекулярной природе электроне плотного вещества в кончиках микроворсинок, которое, по-видимому, ответственно за организацию актиновой сердцевины этих выступов и за контроль их роста и регенерации (разд. 11.2.7).
Даже после того, как все компоненты актиновых сетей будут идентифицированы, останется еще более трудная задача - выяснить, к каким последствиям приводят их многочисленные взаимодействия. Белки, представленные на рис. 11-47, связываются с актином не одновременно и не случайным образом: они кооперируются или(и) конкурируют друг с другом, благодаря чему и возникает упорядоченная картина их взаимоотношений, столь важная для клетки (рис. 11-48). Кроме того, взаимодействия компонентов сети модулируются локальными изменениями в концентрациях ионов и механическими силами, растягивающими или сжимающими сеть и тем самым сдвигающими ее компоненты относительно друг друга. В связи с этим понятно, что изучение всей этой ключевой части цитоскелета находится еще в начальной стадии.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Заключение
В эукариотических клетках имеется особый кортикальный слой акт новых филаментов, лежащий непосредственно под
плазматической мембраной. В целом он представляет собой однородную трехмерную сеть обладающую благодаря поперечным сшивкам, свойствами геля. Вместе с тем кортикальные актиновые филаменты образуют и ряд специализированных структур. Например, пучки актиновых
филаментов, находящихся в комплексе с миозином, прикрепляются к плазматической мембране и обеспечивают клетку структурами, способными
к сокращению. В других участках контролируемая полимеризация актиновых филаментов на их плюс-концах способна выпячивать
плазматическую мембрану наружу, создавая подвижные выступы клеточной поверхности. Разнообразие структур кортекса и выполняемых ими
функций за-висит от обширного спектра актин-связывающих белков, которые cшивают актиновые филаменты в рыхлый гель, объединяют их в
жесткие пучки, движутся по актиновым филаментам, создавая механическое усилие, или прикрепляют их к плазматической мембране.
Некоторые из белков, выполняющих эту последнюю функцию, прикрывают плюс-концы актиновых филаментов, контролируя тем самым их
полимеризацию и деполимеризацию в клетке. Именно этим белкам, как полагают, принадлежит ключевая роль в сложных движениях клеточной
поверхности, например при фагоцитозе или при перемещении клеток по субстрату.
11.3. Движение ресничек [30]
После мышечного сокращения наиболее изученным видом клеточной подвижности является биение ресничек. Реснички - это
миниатюрные волосовидные образования толщиной около 0,25 мкм, построенные из микротрубочек (микротрубочки - это вторая из трех главных груш. нитевидных элементов цитоскелета). Реснички имеются у клеток многих типов и встречаются у большинства животных и некоторых низших растений. Их главная функция - создавать ток жидкости около поверхности клетки или продвигать клетку вперед сквозь толщу воды. Простейшие, например, используют реснички и для передвижения, и для сбора пищевых частиц. У человека огромное множество ресничек (10' и более на 1 см2), принадлежащих клеткам эпителия нижних дыхательных путей, непрерывно перемещает слизь с частицами пыли и остатками отмерших клеток вверх, к ротовой полости, где слизь проглатывается и удаляется. Реснички обеспечивают также передвижение яйцеклетки по яйцеводу, а сходная с ними структура - жгутик -движет сперматозоиды позвоночных.
Подобно тому как изучение мышечного сокращения вносит большой вклад в наше понимание двигательных процессов на основе актина и миозина в немышечных клетках, так и наши знания о механизме биения ресничек помогают понять, каким образом системы микротрубочек порождают движение иного рода - например, обеспечивают внутриклеточный транспорт или процессы, связанные с митозом.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 894; Нарушение авторских прав?; Мы поможем в написании вашей работы!