
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Большинство микротрубочек в животных клетках растет от центросомы, которая служит центром
|
|
|
|
11-24
11-23
11-20
11-19
11-17
11-18
11.3.6, Аксонема движется благодаря скольжению микротрубочек [34]
Если жгутик отделить от клетки с помощью лазерного луча, он сохраняет способность производить волнообразные движения. Это означает, что двигательный аппарат находится в самой аксонеме жгутика, а не в его основании (как в случае жгутиков бактерий, см. разд. 12.5.4).
Действительно, даже изолированная аксонема может совершать движения в солевом растворе, содержащем АТР.
Изгибание ресничек и жгутиков обусловлено взаимным скольжением микротрубочек. Это было показано в экспериментах, где изолированную аксонему обрабатывали протеолитическими ферментами, которые разрушают нексиновые связки и радиальные спицы, оставляя неповрежденными динеиновые ручки и сами микротрубочки. Если к такой частично «переваренной» аксонеме добавить АТР в концентрации всего лишь 10 мкМ, она начинает удлиняться (причем длина ее может превысить первоначальную в 9 раз); это происходит из-за того, что образующие аксонуму волокна (дублеты) телескопически выдвигаются из ослабленной структуры (рис. 11-54). По-видимому, соседние наружные дублеты активно скользят относительно друг друга, будучи освобождены от скрепляющих боковых сшивок (например, нексиновых). В интактной же структуре это скользящее движение преобразуется в изгиб, что схематически показано на рис. 11-55.
11.3.7. За скольжение ответствен динеин [35]
Если дублеты микротрубочек способны активно скользить друг по другу, то должна существовать сила, вызывающая это движение. Эта сила не может создаваться нексиновыми сшивками, так как после их разрушения путем протеолиза способность к скольжению сохраняется. Между тем динеиновые ручки при протеолизе не разрушаются. Обычно ручки, отходящие от каждого наружного дублета аксонемы, не дотягиваются до соседнего дублета, однако они приходят в соприкосновение с ним, когда ресничка израсходует весь свой запас АТР (рис. 11-56).
Диненн - это крупный белковый комплекс, содержащий две или три (в зависимости от источника) глобулярные головки, соединенные с общим основанием тонкими гибкими нитями (рис. 11-57). Каждая глобулярная головка обладает АТРазной активностью, которая усиливается примерно в шесть раз при ассоциации с микротрубочкой. Вся динеиновая ручка состоит из одной молекулы динеина. Кинетические исследования
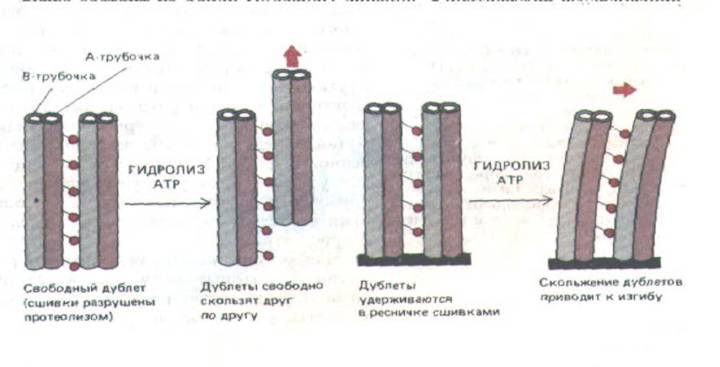
Рис. 11-55. Взаимное скольжение двух наружных дублетов микротрубочек (слева) приводит к изгибу, если дублеты скреплены на одном из концов (справа). Основания молекул динеина соединены только с А-трубочкой, оставляя головки свободными, так что они могут контактировать с соседней В-трубочкой. По-видимому, иная структура В-трубочки мешает связыванию с ней основания молекулы динеина. Такая асимметрия в организации молекул динеина необходима, чтобы предотвратить бесплодное «перетягивание каната» между соседними микротрубочками;
возможно, именно поэтому каждая из девяти внешних микротрубочек представляет собой дублет А-В.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 11-56. Электронная микрофотография реснички (после замораживания-травления). Видны динеиновые ручки, отходящие от дублета микротрубочек через равные интервалы. (С любезного разрешения John Heuser.)
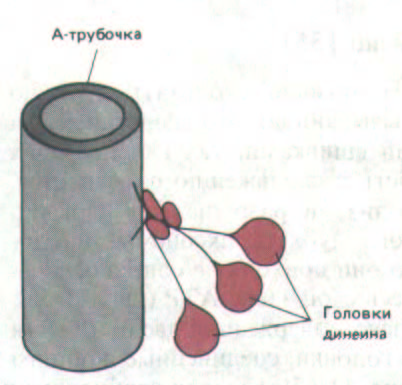
Рис. 11-57. Динеин - крупный белковый комплекс (мол. масса около 2 млн.), в его состав входят от 9 до 12 полипептидных цепей, самая большая из которых с мол. массой около 450 000. Основание молекулы прочно связано с А-трубочкой (это связывание независимо от АТР), тогда как большие глобулярные головки имеют участки для АТР-зависимого присоединения к другой микротрубочке. Когда головки гидролизуют связанный с ними АТР, они движутся по направлению к минус-концу этой второй микротрубочки, вызывая таким образом относительный продольный сдвиг двух соседних дублетов в ресничке или жгутике (см. рис. 11-55).
показывают, что головки, видимо, вызывают скольжение микротрубочек в ресничке с помощью механизма, который в своей основе похож на работу миозиновых головок в мышце (разд. 11.1.10): однонаправленное - от плюс-конца к минус-концу-движение головок динеина по микротрубочке обеспечивается повторными циклами конформационных изменений в каждой головке, обусловленных связыванием и гидролизом АТР. Это движение и создает силу, которая стремится сдвинуть сосед-ний дублет микротрубочек к концу аксонемы (см. рис. 11-55).
11.3.8. Скольжение микротрубочек должно регулироваться, чтобы оно могло вызвать изгиб ресничек [36]
Если бы все динеиновые ручки активировались одновременно, как головки миозина в сокращающейся мышце, то аксонема попросту закрутилась бы в тугую спираль. Поэтому для того, чтобы возник локальный изгиб реснички и чтобы этот изгиб распространялся в виде волны от ее основания до самого кончика, должны существовать специальные регуляторные механизмы, координирующие активность молекул динеина. Эта регуляция не может зависеть от потоков Са2+ или других ионов, поскольку аксонема способна изгибаться и после удаления плазматической мембраны. Судя по всему, активация отдельных динеиновых ручек зависит от механических перемещений других компонентов аксонемы, и сигнал передается динеину через белок-белковые взаимодействия. Важную роль играет также упругость жгутика, который в отсутствие активной работы стремится восстановить равновесную конфигурацию всей структуры.
11.3.9. Аксонему можно изучать генетическими методами [37]
Если выделить аксонемы в очищенном виде и подвергнуть их белки анализу с помощью двумерного электрофореза в полиакриламидном геле (разд. 4.4.5), в них можно обнаружить около 200 различных полипептидов. Изучение функций этих белков и их локализации в аксонеме значительно облегчается при использовании для этой цели мутантних организмов. Излюбленный объект для таких исследований - одноклеточная зеленая водоросль Chlamydomonas reinhardtii, имеющая два жгутика, с помощью которых она плавает (рис. 11-58). Было выделено много мутантов этой водоросли с нарушенной подвижностью. У некоторых из них имеются дефекты в механизме сборки жгутика, и поэтому жгутики не образуются или получаются рудиментарными; у других жгутики есть, но они неподвижны или движутся очень медленно. На электронных микрофотографиях таких мутантных жгутиков можно видеть различные структурные аномалии. У одного класса неподвижных мутантов единственным заметным изменением оказалась потеря динеиновых ручек. У другого класса нет только радиальных спиц, тогда как у третьего отсутствуют одновременно центральная пара микротрубочек и центральная капсула. Изолированные, свободные от мембран аксонемы от мутантов всех трех классов не способны двигаться в присутствии АТР.
Наиболее ценными для понимания работы жгутиков оказались такие мутанты, которые могут двигаться несмотря на утрату некоторых компонентов аксонемы. Выделены, например, медленно плавающие мутанты, у которых нет внутренних или внешних динешювых ручек;
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 11-58. Одноклеточная зеленая водоросль Chlamydomonas reinhardtii. Этот организм плавает с помощью двух жгутиков, которые совместно производят хлыстообразные движения, напоминающие гребок пловца (в отличие от жгутика спермия). (С любезного разрешения John Hopkins.)
следовательно, для создания движущего усилия достаточно присутствия одного-любого - типа динеина, но в норме каждый из них вносит свой вклад в подвижность жгутика. Более неожиданными оказались вторичные мутации, которые восстанавливают подвижность неподвижных жгутиков, лишенных центрального дублета или радиальных спиц, без восстановления исчезнувших компонентов. Существование таких мутантов позволяет думать, что отсутствие центрального дублета или комплекса радиальных спиц каким-то образом выключает активность динеиновых ручек, «замораживая» мотор жгутика, а мутация во втором гене «отключает выключатель» и восстанавливает биение аксонемы. Интересно, что подвижные двойные мутанты с дефектной сердцевиной могут двигаться только по жгутиковому типу и не способны к обычным для Chlamydomonas
хлыстообразным ударам, характерным для ресничек. По-видимому, ресничный тип движения требует более сложной структуры, чем волнообразное движение типичного жгутика (см. рис. 11-50).
Дефекты ресничек и жгутиков встречаются и у человека, например при различных формах наследственного мужского бесплодия, обусловленного неподвижностью спермиев. В зависимости от типа генетической аномалии жгутик спермия может быть лишен динеиновых ручек, головок радиальных спиц или центральной капсулы с одной или обеими центральными микротрубочками. Точно такие же дефекты обнаруживаются в клетках ресничного эпителия этих индивидуумов, и нередко они страдают хроническими респираторными заболеваниями -
рецидивирующим бронхитом и хроническим синуситом: из-за нарушенной функции ресничного эпителия у них не происходит надлежащего удаления слизи из бронхов и придаточных пазух носа. Примечательно, что около половины людей, страдающих таким синдромом неподвижных
ресничек, имеют также весьма редкую особенность - situs inversus viscerum, т. е. обратную симметрию тела, когда сердце расположено справа, печень и аппендикс слева и т.д. (весь комплекс аномалий носит название синдрома Картагенера). В связи с этим было высказано предположение, что однонаправленное биение ресничек на ранних стадиях развития организма может играть ключевую роль в определении нормальной асимметрии нашего тела.
Рассмотрев движение ресничек и жгутиков, мы перейдем теперь к вопросу о том, как они образуются.
11.3.10. Центриоли выполняют в клетке две различные функции [38]
Можно оторвать у Chlamydomonas пару ее жгутиков так, что центриоли сохранятся; в этом случае жгутики быстро образуются вновь.
Почти все необходимые для этого белковые компоненты имеются в растворимой форме в цитоплазме клетки; из них и строятся новые жгутики.
Некоторые стадии сборки могут происходить и в бесклеточных экстрактах: молекулы тубулина полимеризуются в микротрубочки (этот процесс мы подробнее рассмотрим в разделе 11.4), а динеиновые ручки могут снова прикрепляться к аксонеме, с которой они были предварительно смыты раствором с высокой ионной силой. Однако сами по себе белки аксонемы не способны восстановить характерную структуру 9 + 2. Для этого необходима «затравка», играющая роль матрицы, на которой происходит дальнейший рост. В клетке такой затравкой служит иентриоль.
Центриоль - это небольшая цилиндрическая органелла толщиной около 0,2 мкм и длиной 0,4 мкм. Стенку центриоли образуют девять групп из трех слившихся микротрубочек (9 триплетов), причем каждый триплет наклонен в сторону центральной оси под углом 45° к огибающей окружности - как лопатки турбины (рис. 11-59). Соседние триплеты
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
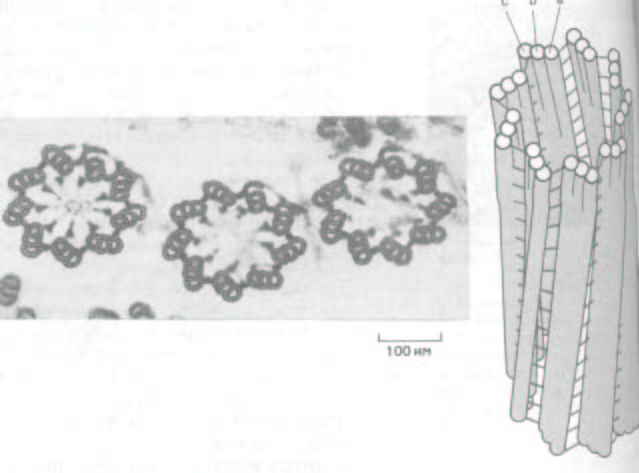
Рис. 11-59. Электронная микрофотография поперечного среза, проходящего через три центриоли в кортексе простейшего. Каждая центриоль (называемая также базальным тельцем) образует нижнюю часть аксонемы реснички. Справа схематическое изображение центриоли.
Центриоль состоит из девяти триплетов микротрубочек, причем каждый триплет (c b a) содержит одну полную микротрубочку и две примыкающие к ней неполные микротрубочки. Особые белки образуют поперечные сшивки, поддерживающие цилиндрическую структуру (выделены цветом). (С любезного разрешения D. Т. Woodrum, R. W. Linck.)
соединены между собой через определенные интервалы, а на электронных микрофотографиях часто видны бледные белковые «спицы», идущие к каждому триплету из центральной области, что напоминает колесо телеги (рис. 11-59, А). Нередко центриоли бывают объединены в пары, где они расположены под прямым углом друг к другу (рис. 11-60).
Центриоль - неизменный компонент аксонемы реснички, и в этом случае ее по традиции называют базалъным тельцем. Специальные отростки, называемые исчерченными корешками, соединяют эту центриоль с другими компонентами цитоскелета. При образовании или регенерации каждый дублет микротрубочек аксонемы берет начало от двух из трех микротрубочек триплета центриоли, так что девятилучевая симметрия центриоли сохраняется в строении аксонемы. Данные радиоавтографии указывают на то, что тубулин и другие белки аксонемы пристраиваются к дистальному концу всей структуры, т. е. к плюс-
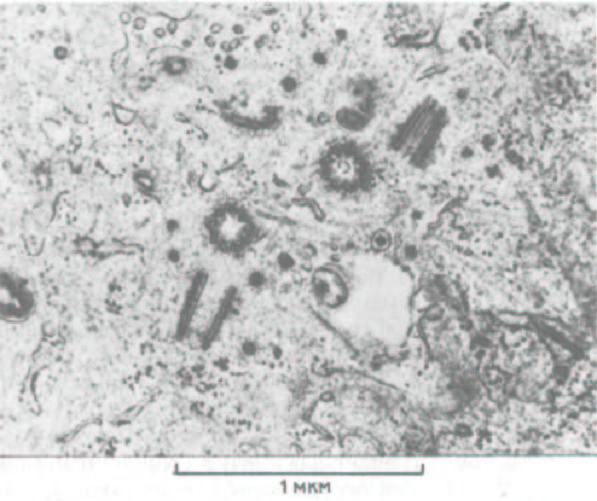
Рис. 11-60. На этой электронной микрофотографии показаны две новые центриоли, которые образовались в результате репликации двух материнских центриолей. На срезе одна центриоль в каждой паре видна в поперечном сечении, а другая в продольном, т.е. в каждой паре центриоли расположены перпендикулярно друг другу. (М. McGill, D. P. Highfield, Т. М. Monahan, R. В. Brinkky. J. Ultrastruct. Res. 57: 43-53, 1976.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
концам микротрубочек. Как в аксонеме возникает центральная пара микротрубочек, не известно; в центриоли этой пары нет.
Те центриоли, которые образуют базальные тельца ресничек, выполняют в клетке весьма специализированную функцию, так как реснички сами по себе - структуры специализированные. Наряду с этим почти во всех животных клетках имеется пара центриолей, которая служит как бы срединным элементом центросомы, или клеточного центра. Центросома (разд. 13.5.2) организует цитоплазматические микротрубочки в интерфазных клетках, а в делящихся клетках удваивается и дает начало двум полюсам митотического веретена (мы обсудим это в следующем разделе). Иногда центриоли могут выполнять поочередно то одну функцию, то другую: у Chlamydomonas, например, перед каждым митозом оба жгутика исчезают, а базальные тельца покидают свое место, чтобы стать полюсами веретена.
11.3.11. Новые центриоли обычно возникают путем дупликации уже имеющихся [39]
На фоне непрерывного увеличения массы животной клетки в ходе клеточного цикла выделяются два дискретных акта дупликации:
удвоение числа хромосом (репликация ДНК) и удвоение центриолей. В культивируемых фибробластах последний процесс приблизительно совпадает по времени с началом синтеза ДНК. Прежде всего происходит разделение двух «половинок» центриолярной пары, а затем на каждой такой «половинке» достраивается дочерняя центриоль - снова под прямым углом к исходной (рис. 11-60). Незрелая центриоль содержит 9
одиночных микротрубочек; по-видимому, каждая микротрубочка затем становится матрицей при сборке триплетов, свойственных зрелой центриоли.
У позвоночных ресничные клетки могут нести сотни ресничек, и центриоли клеток-предшественников обеспечивают образование необходимого числа базальных телец. Например, при дифференцировке клеток ресничного эпителия яйцеводов и трахеи пара центриолей перемещается со своего обычного места около ядра в апикальную область клетки, где будут формироваться реснички. Там, вместо того чтобы образовать, как обычно, одну дочернюю центриоль, каждая материнская центриоль дает начало многочисленным электроноплотным «сателлитам».
Из этих сателлитов и образуются затем базальные тельца, которые мигрируют к плазматической мембране, чтобы инициировать там рост ресничек.
Однако известны случаи, когда центриоли, по всей видимости, возникают de novo. Так, хотя неоплодотворенные яйцеклетки многих животных лишены функционирующих центриолей и для первого митотического деления (после оплодотворения) используют центриоли спермиев (разд. 15.4.8), в определенных экспериментальных условиях (резкое нарушение ионного баланса или электрическая стимуляция) они могут образовывать различное число центриолей. Каждая такая центриоль инициирует образование небольшой фигуры звезды, и одна из этих звезд может затем использоваться клеткой для деления; при этом из неоплодотворенной яйцеклетки развивается гаплоидный организм (такой ход событий называется партеногенезом - см. разд. 13.4.8). Вероятно, в цитоплазме неоплодотворенных яйцеклеток имеются какие-то предшественники центриолей, которые при особых обстоятельствах могут превращаться в новые настоящие центриоли.
Необычный способ удвоения центриолей и их непрерывность в длинном ряду клеточных поколений заставили в свое время предположить, что центриоли представляют собой полностью автономные, саморепли-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
цирующиеся органеллы. Хотя сейчас мы знаем, что это не так и при определенных условиях они могут образовываться в цитоплазме de novo, возможно все же, что какая-то часть информации, необходимая для формирования центриолей, содержится в них самих (подобно тому как размножение митохондрий и хлоропластов зависит от их собственных, внехромосомных генов-см. разд. 7.5). У Chlamydomonas группа генов, которые кодируют белки, участвующие в создании структуры базальных телец и аксонем, находится в дискретном генетическом элементе, и этот элемент передается дочерним клеткам независимо oт основных хромосом; его природу и локализацию, однако, еще предстоит выяснить.
Заключение
Реснички и жгутики эукариот содержат цилиндрический пучок из девяти дублетов микротрубочек. Скольжение дублетов
относительно друг друга преобразуется в изгиб pecничкu или жгутика. Силу, сдвигающую дублеты, создают боковые динеиновые ручки, которые
тянутся от каждого дублета к соседнему; они используют для этого энергию гидролиза АТР. Ряд вспомогательных белков «увязывает» дублеты
в цилиндрическую структуру и ограничивает амплитуду их скольжения. Другие вспомогательные белки образуют своего рода «молекулярна-
механическое реле», регулирующее активность динеина таким образом, что изгибание реснички совершается циклически, и это обеспечивает
характерное для ресничек биение. Сложная структура аксонемы образуется путем самосборки белковых компонентов, а нуклеацию процесса
сборки осуществляет цент-риоль (базальнеє тельце), которая служит матрицей для формирования специфической структуры аксонемы-
системы дублетов микротрубочек типа 9 + 2.
11.4. Цитоплазматические микротрубочки [40]
Почти во всех животных клетках актин и тубулин содержатся в больших количествах, но тубулина в них все же, как правило, меньше.
Кроме того, поскольку микротрубочки толще, чем актиновые филаменты, для образования полимера одинаковой длины тубулина требуется примерно в 10 раз больше, чем актина (см. табл. 11-4). Поэтому общая длина актиновых филаментов в клетке по крайней мере в 30 раз больше общей длины микротрубочек. Это отражает фундаментальную разницу в структурной организации и функциях этих двух цитоскелетных полимеров: в то время как актиновые филаменты образуют соединенные сшивками сети и небольшие пучки в периферической цитоплазме, микротрубочки обычно существуют в виде отдельных нитей, которые расходятся в стороны через всю цитоплазму из небольшой области вблизи ядра. Микротрубочки образуют систему волокон, по которой могут перемещаться различные пузырьки и другие органеллы, ограниченные мембраной; тем самым они влияют на полярность клетки, могут регулировать ее форму и движение и определяют ориентацию плоскости клеточного деления.
11.4.1. Микротрубочки - это высоколабильные структуры, чувствительные к антимитотическим агентам [41]
Многие системы микротрубочек в клетках весьма лабильны, причем эта лабильность важна для их функции. Один из наиболее ярких примеров-митотическое веретено, которое образуется после того, как в начале митоза микротрубочки цитоплазмы распадаются (разд. 13.5.2).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Рис. 11-61. Химическая структура колхицина.

Рис. 11-62. Полярность микротрубочек, выявленная методом «навешивания крючков». В данной группе все микротрубочки (они видны на этой электронной микрофотографии в поперечном разрезе) имеют одинаковую полярность. Крючки, образованные присоединившимися сбоку молекулами тубулина, изогнуты по часовой стрелке, и это означает, что мы смотрим на микротрубочки вдоль в направлении от плюс-конца к минус-концу. Полярность микротрубочки можно также выявить путем присоединения молекул динеина (не показано). (По U. Euteneuer, Cell Muscle Motil. 5: 1-82, 1984, с изменениями.)
| Таблица 11-3. Некоторые вещества, связывающиеся с тубулином (антимитотические агенты) | |
| Вещество | Механизм действия |
| Колхицин, колцемид, нокодазол | Ингибируют присоединение молекул тубулина к микротрубочкам, вызывая деполимеризацию последних |
| Винбластин, винкристин | Вызывают образование паракристаллических агрегатов тубулина, что приводит к деполимеризации микротрубочек |
| Таксол | Стабилизирует микротрубочки, прочно связываясь с полимером |
Микротрубочки митотического веретена пребывают в состоянии необычайно быстрой сборки и разборки, что объясняет крайнюю чувствительность веретена к различным препаратам, способным связываться с тубулином (разд. 13.5.2). Один из алкалоидов безвременника осеннего, колхицин, использовался в лечебных целях еще древними египтянами. Молекулы колхицина (рис. 11-61) прочно связываются с молекулами тубулина (образуя эквимолярный комплекс) и препятствуют тем самым их полимеризации; поэтому обработка делящихся клеток колхицином вызывает через несколько минут исчезновение митотического веретена и блокирует клетки в митозе. Вещества, обладающие подобным действием, называются антимитотическими агентами (табл. 11-3). Во многих случаях их действие обратимо, и удаление препарата дает возможность веретену образоваться вновь, а митозу завершиться. Так как разрушение микротрубочек веретена избирательно убивает многие быстро делящиеся клетки, ряд антимитотических препаратов, в частности вин-бластин и винкристин, широко используются в терапии рака.
Другое вещество - таксол - оказывает противоположное действие. Он прочно связывается с микротрубочками и стабилизирует их. Будучи добавлен к клеткам, он заставляет значительную часть тубулина включиться в микротрубочки. Подобно тому как стабилизация актиновых филаментов фаллоидином останавливает миграцию клеток, стабилизация микротрубочек таксолом фиксирует делящиеся клетки в митозе.
Так же как и полимеризация актиновых филаментов, сборка микротрубочек имеет сложную кинетику, что играет важную роль во многих клеточных процессах. Большая часть наших знаний о динамическом поведении микротрубочек была получена при изучении полимеризации очищенного тубулина in vitro.
11.4.2. Противоположные концы микротрубочек различны и растут с разной скоростью [42]
Мы уже говорили о том, что микротрубочки обладают полярностью: мономеры тубулина в них определенным образом ориентированы.
Как и в случае актиновых филаментов, структурная полярность микротрубочек обусловливает различия между их двумя концами, важные для понимания того, как образуются микротрубочки в клетках. Если растворенному тубулину дать возможность некоторое время полимеризовать-ся на фрагментах аксонемы, а затем исследовать в электронном микроскопе то, что получилось, будет видно, что одни концы микротрубочек удлиняются втрое быстрей других. Быстро растущие концы были названы плюс-концами, а медленно растущие -минус-концами.
Полярность микротрубочек можно определить и на их поперечных срезах, если предварительно добавить к ним растворенные молекулы тубулина; в определенных условиях мономеры тубулина будут при-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
соединяться к микротрубочкам не с концов, а с боков, образуя искривленные листки из протофиламентов. На поперечном срезе эти листа напоминают крючья, загнутые в ту или другую сторону в зависимости от полярности микротрубочки (рис. 11-62). Таким способом, например, удалось показать, что в аксонах нервных клеток и в ресничках все микротрубочки имеют одинаковую полярность: те их концы, что расположены дальше от тела клетки, всегда бывают плюс-концами. Когда микротрубочки растут от центров их организации (от центросом или полюсов веретена), их плюс-концы тоже всегда обращены вперед по направлению роста (рис. 11-63).
11.4.3. Гидролиз нуклеотида усиливает нестабильность медленно растущих микротрубочек [43]
В некоторых отношениях сборка молекул тубулина в микротрубочкя напоминает полимеризацию актина. Она самопроизвольно протекает in vitro и в норме сопровождается гидролизом одной молекулы связанного нуклеотида на каждый присоединенный мономер (нуклеотид в случае сборки тубулина - не АТР, a GTP, см. табл. 11-4). Энергия, освобождаемая при гидролизе нуклеотида, для полимеризации не нужна: тубулин благополучно полимеризуется и тогда, когда с ним связан негидролизуемый аналог GTP-GTPγS. Однако гидролиз нуклеотида приводит к тому, что критическая концентрация для полимеризации на плюс-конце оказывается ниже, чем для полимеризации на минус-конце; иными (словами, с плюс-
концом мономеры актина или тубулина связываются прочнее (см. схему 11-1 в разд. 11.2.10). Благодаря этому в случае актиновых филаментов возможен непрерывный тредмиллинг субъединиц по полимеру (разд. 11.2.10). Хотя в принципе тредмиллинг может происходить и в микротрубочках, фактически здесь, видимо, доминирует явление, получившее название динамической нестабильности.
Динамическую нестабильность можно продемонстрировать просто с помощью светового микроскопа, оборудованного темнопольной оптикой и видеоприставкой, наблюдая за процессом сборки микротрубочек из очищенного тубулина на предметном стекле. В этих условиях видно, что концы отдельных микротрубочек либо медленно растут, либо быстро укорачиваются; каждая стадия длится многие секунды, а переход; от роста к укорочению и обратно происходит случайным образом
| Таблица 11-4. Сравнение полимеров актина и тубулина | ||
| Актин | Тубулин | |
| Мол. масса полипептида | 50000 (a-тубулин) | |
| 50000 (ß-тубулин) | ||
| Неполимерная форма | Глобулярный мономер | Глобулярный димер (Ια +1β) |
| Нуклеотид, связываемый неполимерной формой | АТР (1 на мономер) | GTP (2 на димер) |
| Структура полимера | Спиральная нить | Полая трубка из 13 протофиламентов |
| Толщина фибриллярной структуры | 8 нм | 25 нм |
| Число субъединиц на 1 мкм длины полимера | 370 мономеров | 1600 димеров |
| Мол. масса на 1 мкм длины полимера | 370 x 42000 = 15,5 х106 | 1600 x 100000 =160 х 106 |
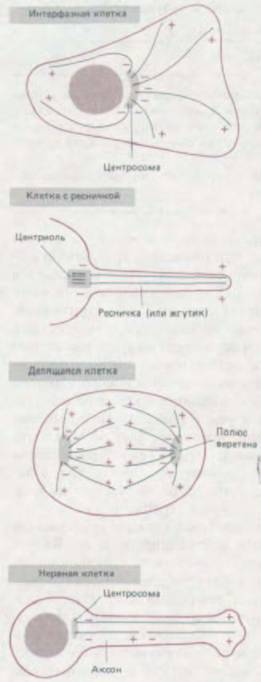
Рис. 11-63. Минус-концы микротрубочек в клетках обычно находятся в центре организации микротрубочек, а плюс-концы часто располагаются вблизи плазматической мембраны.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
НАБЛЮДАЕМОЕ ПОВЕДЕНИЕ МИКРОТРУБОЧЕК Микротрубочки - динамичные структуры, и процессы их сборки и разборки определяют, где и когда они будут существовать в клетке.
Подобно актиновым филаментам, они растут за счет обратимого присоединения субъединиц, которое сопровождается их информационным изменением и гидролизом нуклеотида (см. схему 11-1 в разд. 11.2.10). Однако полимеризация микротрубочек имеет некоторые особенности, отличающие ее от сборки актиновых филаментов.
В клетках минус-концы микротрубочек прочно связаны с центрами организации микротрубочек, что предотвращает (или контролирует)
сборку и разборку субъединиц на этих концах (разд. 11.4.4). Поэтому мы будем рассматривать только плюс-концы. In vitro плюс-конец отдельной микротрубочки самопроизвольно переходит от состояния медленного роста к состоянию быстрого укорочения и обратно, причем каждое состояние продолжается много секунд. В любой данный момент популяция микротрубочек в целом состоит из полимеров двух типов, переходы между которыми происходят относительно медленно:


Это поведение, названное динамической нестабильностью, можно объяснить, если вспомнить, как влияет на полимеризацию задержка гидролиза GTP.
СТРУКТУРНАЯ ОСНОВА ДИНАМИЧЕСКОЙ НЕСТАБИЛЬНОСТИ Изменения, которые происходят с молекулами тубулина при их полимеризации, в основе своей такие же, как и в случае с актином. Поэтому мы воспользуемся теми же обозначениями, что и в схеме 11-1:  будет означать мономер, несущий GTP,
будет означать мономер, несущий GTP,  — субъединицу в составе полимера, уже претерпевшую конформационное изменение, но все еще с GTP (до его гидролиза), а
— субъединицу в составе полимера, уже претерпевшую конформационное изменение, но все еще с GTP (до его гидролиза), а 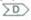 - субъединицу в составе полимера, несущую GDP (после гидролиза GTP).
- субъединицу в составе полимера, несущую GDP (после гидролиза GTP).
Поскольку гидролиз GTP осуществляется лишь после включения субъединицы в полимер, субъединицы типа  будут обычно обнаруживаться только на растущем конце микротрубочки. Эта "шапка' из субъединиц типа
будут обычно обнаруживаться только на растущем конце микротрубочки. Эта "шапка' из субъединиц типа  должна быть тем больше, чем быстрее растет трубочка:
должна быть тем больше, чем быстрее растет трубочка:

Так как субъединицы типа  диссоциируют легче, чем
диссоциируют легче, чем  , всякий конец, потеряв "шапку" из
, всякий конец, потеряв "шапку" из  , начнет терять субъединицы (деполимеризоваться) с большей скоростью. (От конца с
, начнет терять субъединицы (деполимеризоваться) с большей скоростью. (От конца с 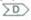 микротрубочки отделяются примерно в 100 раз быстрее, чем от конца с
микротрубочки отделяются примерно в 100 раз быстрее, чем от конца с  .
.
Поэтому, если началась быстрая деполимеризация, новой  шапке образоваться трудно. Вдобавок микротрубочки, видимо, могут претерпевать дальнейшее структурное изменение, в результате которого они теряют способность легко присоединять субъединицы тубулина.
шапке образоваться трудно. Вдобавок микротрубочки, видимо, могут претерпевать дальнейшее структурное изменение, в результате которого они теряют способность легко присоединять субъединицы тубулина.

В показанном здесь случае "шапка" на микротрубочке зачастую так и не образуется, и тогда микротрубочка продолжает укорачиваться вплоть до полного распада.
У ОТДЕЛЬНОЙ МИКРОТРУБОЧКИ СТАЦИОНАРНОЕ СОСТОЯНИЕ ОТСУТСТВУЕТ При стационарном состоянии концентрация свободных субъединиц - [С] -постоянна, так что [доля укорачивающихся микротрубочек] х [скорость деполимеризации] =
= [доля растущих микротрубочек] х [скорость полимеризации]
Так как скорость деполимеризации гораздо выше скорости роста, в любой момент времени много микротрубочек растет и лишь малая доля их укорачивается. Критической концентрации свободного тубулина, при которой отдельная микротрубочка имела бы неизменную длину, просто не существует; вместо этого в широком диапазоне [С] мы находим смесь растущих и укорачивающихся микротрубочек. Хотя при высоких [С] наблюдаемая доля растущих микротрубочек возрастает, каждая отдельная микротрубочка (в отличие от актинового филамента) никогда не достигает стабильного "стационарного состояния".
ВАЖНОСТЬ "ЗАЩИТЫ" КОНЦОВ ПОЛИМЕРА Из-за своей динамической нестабильности вновь организованная микротрубочка сможет сохраниться лишь в том случае, если оба конца защищены от деполимеризации. Минус-концы микротрубочек в клетках обычно защищены тем центром организации микротрубочек, из которого они растут, а некоторые плюс-концы, как полагают, прикрыты специальными белками, контролирующими стабильность, а тем самым и расположение микротрубочек в клетке. Так, в неполяризованной клетке (А) новые микротрубочки могут расти и укорачиваться равновероятно во всех направлениях от центросомы. Затем какая-то часть их вступает в определенном участке в контакт со структурами клеточного кортекса, которые могут кэпировать свободные плюс-концы микротрубочек (Б). Избирательная стабилизация тех микротрубочек, которые случайно столкнулись с этими кэпирующими структурами, приведет в результате к быстрому перераспределению всей массы микротрубочек и превращению клетки в полярную (В и Г).
Схема 11-2. Полимеризация микротрубочек.
Вообще говоря, можно было бы ожидать, что и актиновые филаменты будут проявлять динамическую нестабильность. Однако концы этих филаментов устроены много проще, чем концы микротрубочек, и сами филаменты, судя по всему, так легко переходят от фазы роста к фазе укорочения и обратно, что их поведение выглядит иначе — см. схему 11-1.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
(рис. 11-64). Вероятное объяснение этой динамической нестабильное приведено на схеме 11-2. Как полагают, это следствие «запаздывающего»
гидролиза GTP, происходящего при сборке микротрубочки. При ее быстром росте присоединение молекул тубулина к полимеру идет быстрее, чем гидролиз связанных с ними молекул GTP. В результате на растущем конце микротрубочки образуется «шапочка» из GTP; а так как молекулы тубулина, несущие GTP, связываются между собой с большим сродством, чем несущие GDP, эта «шапочка» благоприятствует дальнейшему росту микротрубочки. Если же микротрубочка почему-либо лишится своей шапочки из GTP (например, вследствие замедлении полимеризации), то она начнет укорачиваться и будет склонна продолжать укорачиваться и дальше. Следует отметить, правда, что укорочению микротрубочек, по-
видимому, существенно способствуют и другие факторы, например устойчивое искажение упаковки тубулина, обычно возникающее на конце микротрубочки (см. схему 11-2).
Как мы сейчас увидим, динамическая нестабильность позволяет клетке контролировать расположение своих микротрубочек с помощью специальных цитоплазматических структур, которые связываются с концами микротрубочек и стабилизируют их.
организации микротрубочек [44]
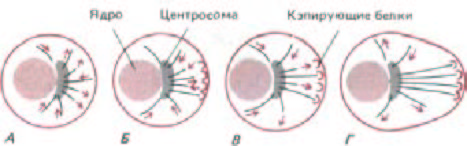
Микротрубочки в цитоплазме интерфазной клетки, растущей in vitro, можно увидеть, если клетку зафиксировать и окрасить флуоресцентными антителами к тубулину. Наиболее густо они расположены вокруг ядра, откуда расходятся радиально к периферии в виде тонких переплетенных нитей (рис. 11-65, А). Откуда начинается рост микротрубочек в клетке, становится ясно, если их деполимеризовать с помощью колхицина, а затем позволить вырасти заново (рис. 11-65, Б). Регенерирующие микротрубочки вначале появляются в виде небольшой околоядерной лучистой структуры, называемой звездой. Затем ее лучи удлиняются по направлению к периферии клетки, пока не восстановится их первоначальное распределение. Если пометить микротрубочки культивируемой клетки тубулиновыми «крючками» (для определения полярности), можно увидеть, что у всех у них плюс-концы обращены в сторону от центра организации микротрубочек - точки, в которой образуется звезда, Главным центром образования микротрубочек почти во всех животных клетках служит клеточный центр, или центросома. Центросома расположена сбоку от ядра и содержит пару центриолей, лежащих под прямым углом друг к другу (в форме буквы L, см. рис. 11-60). Однако не во всех центрах организации микротрубочек есть центриоли. Например, в митотических клетках высших растений концы микротрубочек погружены в слабо структурированную электроноплотную область, где никаких центриолей нет. Центриоли не обнаруживаются также в мейоти-

Рис. 11-64. Изменения длины одной микротрубочки, выявленные с помощью видеосъемки в темном поле микроскопа. Изображения регистрировали с интервалом 1 -2 мин и располагали в последовательном порядке на экране монитора. Два конца проходят через циклы удлинения и укорочения независимо, причем флуктуации на плюс-конце сильнее. (Т. Ног.о и Н. Hotani, Nature 321: 605-607, 1986.)
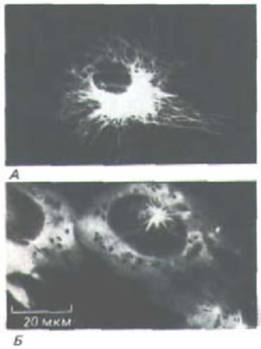
Рис. 11-65. Распределение микротрубочек в культивируемых клетках (иммунофлуоресцентные микрофотографии, окраска антителами к тубулину). А. Нормальная клетка. Б. Клетки были обработаны колцемидом в течение часа, чтобы деполимеризовать их микротрубочки, после чего им дали возможность восстановиться: микротрубочки появляются вначале как маленькие звездочки, а затем удлиняются по направлению к периферии клетки. (А-с любезного разрешения Eric Karsenti и Marc Kirschner; Б-из М. Osborn, К. Weber, Ргос. Natl. Acad. Sci. USA 73: 867-871, 1976.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Рис. 11-66. Центриоли могут быть центрами организации для систем микротрубочек совершенно разного типа. Две центриоли в клетке слева служат базальними тельцами для аксонем ресничек, тогда как в клетке справа две центриоли образуют часть организующего центра (центросомы) для микротрубочек, радиально расходящихся по всей цитоплазме. Обратите внимание, что во втором случае микротрубочки растут не из самой центриоли, а из аморфного перицентриолярного материала.
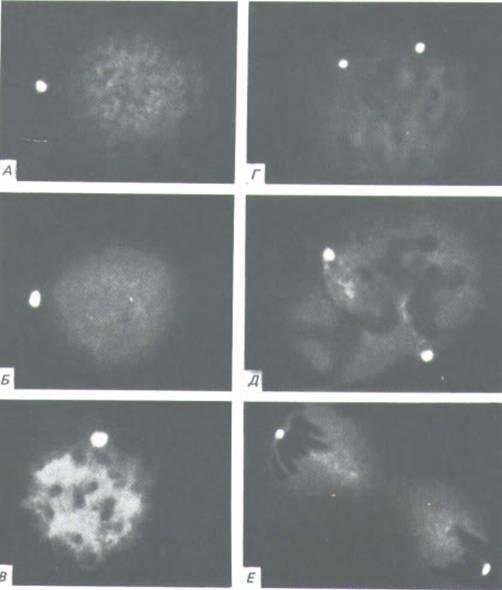
Рис. 11-67. Центросоми в интерфазных и митотических животных клетках, окрашенных флуоресцентными антителами к центросомному белку. Эти микрофотографии иллюстрируют удвоение и расхождение центросом в процессе деления клетки. А и Б-интерфаза; В и Г- профаза; Д-
метафаза; Е-телофа-за. Описание стадий митоза см. в разд. 13.5.1. (S. L. Brenner, B.R. Brinkley, Cold Spring Harbor Symp. Quant. Biol. 46: 241-254, 1981. С любезного разрешения Bill Brinkley.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ческом веретене мышиных ооцитов, хотя позже в ходе развития эмбриона они появляются.
Таким образом, в отличие от аксонемы ресничек, которая вырастает непосредственно из края центриоли (разд. 11.3.10), цитоплазматические микротрубочки прямо от центриоли не растут: для их нуклеации необходимо только облако окружающего центриоль аморфного материала (рис. 11-66). Из чего он состоит, в точности не известно, однако антителами к одному из его белковых компонентов можно окрашивать центр организации микротрубочек как в растительных, так и в животных клетках; значит, этот белок эволюционно очень консервативен (рис. 11-67). Если центросомы (центриоли вместе с перицентриолярным веществом) выделить из клетки и смешать с очищенным тубулином, они будут быстро инициировать сборку микротрубочек in vitro. В таких микротрубочках, как и в образующихся in vivo, минус-концы погружены в перицентриолярное вещество. При этом каждая изолированная центросома, по-видимому, может дать начало строго определенному числу микротрубочек, и это число близко к тому, которое образует центросома в соответствующей клетке (например, в интерфазном фибробласте - около 250). Создается впечатление, что центросома имеет фиксированное число нуклеирующих элементов.
У растений и простейших встречаются разные типы центров организации микротрубочек. Например, клеточный рот инфузорий снабжен корзинкой - сложной структурой, которая играет роль глотки и состоит из рядов микротрубочек, расходящихся от нижней поверхности трехслойной пластинки (рис. 11-68). С самого начала процесса сборки эти микротрубочки расположены в виде гексагональной решетки: по-
видимому, этот центр организации содержит соответственно упорядоченную систему нуклеирующих элементов.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 2219; Нарушение авторских прав?; Мы поможем в написании вашей работы!